Тема 2. Химическая связь
Цели и задачи:
На фактическом уровне получения знаний:
1. Понятие молекулы и иона;
2. Основные положения теории химического строения А.М. Бутлерова;
3. Понятие химической связи;
4. Условия и механизмы образования химической связи;
5. Методы описания химической связи, ВС и МО;
6. Характеристики, виды и свойства химических связей;
7. Теории гибридизации и валентность;
На операционном уровне получения знаний:
Обучить студента:
1. Определять виды химической связи в молекулах, ионах, кристаллах;
2. Оценивать полярность связи;
3. Рассчитывать степени окисления атомов в молекулах и ионах;
4. Составлять валентные схемы молекул и комплексных ионов;
5. Определять основные типы гибридизации атомов и геометрию молекул.
На аналитическом уровне получения знаний:
Обучить студента:
1. Оценивать основные свойства газов, жидких и твердых веществ на основании знаний о химических связях в их молекулах;
2. Прогнозировать физические и химические свойства твердого вещества по природе частиц и типу химической связи между ними;
3. Оценивать донорно-акцепторные свойства ионов и атомов элементов.
Фактический материал:
I. Основное условие образования химической связи между атомами -выброс энергии из системы взаимодействующих атомов, рассмотреть на примере функциональной зависимости энергии системы от межядерного расстояния при образовании молекулы водорода. Привести основные виды химической связи в веществе: ковалентная (неполярная, полярная), ионная, металлическая.
Механизмы образования ковалентной связи:
1) Обменный механизм, основные положения теории химической связи – метода валентных связей (ВС): а) взаимодействие одноэлектронных атомных орбиталей двух атомов с антипараллельными спинами с образованием общей электронной пары; б) возникновение в межядерном пространстве области увеличенной электронной плотности, несущей избыточный отрицательный заряд; в) притяжение положительно заряженный ядер атомов к области увеличенной электронной плотности при строго фиксированном межядерном расстоянии, которое соответствует минимальному энергетическому запасу возникшей молекулы.
2) Донорно-акцепторный механизм, понятие донора и акцептора (на примере образования молекулы водорода при взаимодействии двух ионов водорода  ).
).
II. Изложить основные характеристик ковалентной связи: а) что такое энергия связи и от чего зависит ее величина; б) длина связи (величина межядерного расстояния), как влияет длина связи и ее энергия на прочность молекулы (энергию диссоциации молекулы на атомы); в) насыщаемость ковалентной связи, ковалентность атома (понятие валентности элемента, как количества квантовых орбиталей, предоставленных атомом на образование определенного количества общих электронных пар с другими атомами), рассмотреть на примере образования водородных соединений бора, углерода и азота; г) направленность ковалентной связи (образование 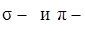 связи); д) поляризуемость ковалентной связи (образование неполярной и полярной связи), характеристика полярности связи – дипольный момент молекулы. Понятие электроотрицательности атома (как полусуммы энергий ионизации и сродства к электрону), определяющей сдвиг общей электронной пары на один из атомов при образовании связи. Таблица относительных значений электроотрицательности.
связи); д) поляризуемость ковалентной связи (образование неполярной и полярной связи), характеристика полярности связи – дипольный момент молекулы. Понятие электроотрицательности атома (как полусуммы энергий ионизации и сродства к электрону), определяющей сдвиг общей электронной пары на один из атомов при образовании связи. Таблица относительных значений электроотрицательности.
III. Явление гибридизации валентных орбиталей атомов элементов второго периода ( гибридизация), показать на примере углерода в его водородных соединениях, графите и алмазе. Привести примеры и объяснить пространственное строение и полярность: линейных неполярных 3-х атомных молекул (
гибридизация), показать на примере углерода в его водородных соединениях, графите и алмазе. Привести примеры и объяснить пространственное строение и полярность: линейных неполярных 3-х атомных молекул ( ), угловых 3-х атомных полярных молекул (
), угловых 3-х атомных полярных молекул (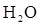 ), 4-х атомных неполярных молекул (
), 4-х атомных неполярных молекул ( ), полярных (
), полярных (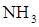 ).
).
IV. Предельный случай сильно полярной ковалентной связи является связь ионная, ее характеристики (ненаправленность и ненасыщенность). Энергия ионной связи, которая пропорциональна произведению зарядов ионов и обратно пропорциональна длине ионной связи. Неполное разделение зарядов в ионных соединениях, взаимная поляризация ионов, как следствие деформации электронных оболочек ионов. Факторы влияющие на поляризуемость ионов и поляризующую способность: а) величина ионного радиуса (чем больше значение радиуса, тем выше поляризуемость иона и меньше поляризующая способность); б)степень гидратации иона (чем выше степень гидратации, тем меньше его поляризуемость); в) величина заряда иона (чем больше заряд иона, тем выше поляризующая способность). Т.к. размеры анионов ,как правило, больше радиусов катионов, анионы обладают меньшей поляризующей способностью, но сильной поляризуемостью.
V. Дать общее понятие о комплексных соединениях, как соединениях характеризуемых наличием двух видов связи: а) ионной (во внешней координационной сфере); б) ковалентной донорно-акцепторной (во внутренней координационной сфере). Привести координационную формулу комплексного соединения (например 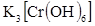 ). Кратко изложить: а) теорию строения комплексов (понятия: комплексообразователь, лиганд, координационное число); б)процессы первичной и вторичной диссоциации; в) количественную характеристику устойчивости комплексной частицы (выражение константы нестойкости).
). Кратко изложить: а) теорию строения комплексов (понятия: комплексообразователь, лиганд, координационное число); б)процессы первичной и вторичной диссоциации; в) количественную характеристику устойчивости комплексной частицы (выражение константы нестойкости).
VI. Общие представления о теории молекулярных орбиталей (расщепление энергии валентных орбиталей взаимодействующих атомов), на примере энергетических диаграмм образования молекул водорода и кислорода. Основные положения зонной теории кристаллов металлов: а) образование непрерывной энергетической зоны (НЭЗ); б) заполнение электронами энергетических уровней НЭЗ согласно правилам квантовой механики; в) деление НЭЗ на две подзоны (валентную зону и зону проводимости); г) возникновение электронного газа в кристалле, как совокупности делокализованных электронов в зоне проводимости. Понятие металлической связи, как общей электронной плотности, обусловленной совокупностью делокализованных электронов. Основные физико-механические свойства кристаллов металлов, обусловленные наличием металлической связи: электропроводность, теплопроводность, пластичность (способность к упругой деформации), ковкость и др.
Выводы по теме:
1. Виды химичесих связей в зависимости от природы образующих их частиц подразделяются на ковалентную, ионную, металлическую и водородную.
2. Ковалентная связь формируется обменным и донорно-акцепторным взаимодействиями. Характеристиками связи являются энергия, длина, насыщаемость, направленность, кратность. Свойства соединений определяются типом их решетки.
3. Ионная связь образуется вследствие электростатического взаимодействия атомов диаметрально противоположной природы. Ионные соединения представлены ионной кристаллической решеткой, параметры и характеристики которой определяют свойства ионных соединений.
4. Металлическая связь является многоценровой, ненаправленной, ненасыщаемой. Свойства металлической кристаллической решетки определяют свойства металлических тел..
Вопросы для самопроверки:
1. Сколько электронов участвует в образовании химических связей в молекуле аммиака:
а) 8; б)6; в)3.
2. Выбрать вещества, все связи которых ковалентные:
а)NaCl, HCl,Cu,H2O;
б)CO2, CH4, H2SO4, J2;
в)SO2, HNO2, NaOH, PbO.
3. В каком ряду молекулы расположены в порядке увеличения полярности связей:
а)HF, HCl, HBr;
б) NH3, PH3, AsH3;
в)H2Se, H2S, H2O.
4. Отметить формулы соединений с одинаковой степенью окисления азота:
а) Mg3N2; б)NO; в) NO2; г)NH3.
5. В каких частицах наблюдается только sp3- гибридизация центрального атома:
а) NH3, H2O, C2H4, [Zn(NH3)4]2+;
б)H2O, NH3, C2H2, [HgJ4]2-;
в)NH3, NH4+, CH4 , [Zn(NH3)4]2+ .
Указать другие типы гибридизации в этих соединениях.
6. Валентность атома азота численно равна его степени окисления в молекуле:
а) аммиака; б) азотной кислоты; в) азота; г) оксида азота (II).