Определение теплового эффекта реакции нейтрализации
Цель работы:освоить методику экспериментального определения теплового эффекта реакции нейтрализации сильной кислоты сильным основанием.
Рекомендации:при подготовке к работе необходимо повторить раздел «Химическая термодинамика», ответить на все контрольные вопросы.
Важнейшие понятия:система (гомогенная и гетерогенная); термодинамические системы (открытая, закрытая, изолированная); термодинамические параметры состояния (экстенсивные и интенсивные); термодинамические функции состояния, внутренняя энергия, энтальпия, энтропия, свободная энергия Гиббса, энтальпия образования, энтальпия сгорания, стандартные состояния и условия, тепловой эффект, экзо- и эндотермические реакции, термодинамическая вероятность системы, термохимия.
Следует уметь:объяснять все важнейшие понятия и давать им определения; определять тип системы; записывать термохимические уравнения; рассчитывать тепловой эффект химических ифизико-химических процессов; оценивать термическую устойчивость соединений на основании закона Гесса; рассчитывать изменение внутренней энергии, энтропии и свободной энергии системы в различных процессах; объяснять термодинамические критерии возможности самопроизвольного протекания процесса и состояния равновесия.
Контрольные вопросы и задания:
1. Как изменяется энтальпия системы, если реакция идет с поглощением тепла?
2. Вычислить тепловой эффект реакции
NaH(k)+H2O(ж)=NaOH(р)+H2(г)
по стандартным энтальпиям образования веществ, участвующих в реакции, если 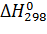 (NaH(k))=-56,94 кДж/моль,
(NaH(k))=-56,94 кДж/моль, 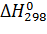 (NaOH(р)) = 469,47 кДж/моль,
(NaOH(р)) = 469,47 кДж/моль, 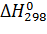 (H2O(ж)) =-285,84 кДж/моль.
(H2O(ж)) =-285,84 кДж/моль.
3. Определить знак изменения энтропии в следующих реакциях:
4NH3+ЗО2=6Н2О(ж)+2N2
СН4(Ж)+4CI2=CCI4(ж)+4HCI
СО+ЗН2=СH4+Н2О(ж)
4. В каком направлении нижеприведенная реакция будет протекать самопроизвольно?
N2+2H2O=NH4NO2,
если ∆G0298(NH4NO2)=l 15,94кДж/моль, ∆G0298(H2O(г))= -228,8кДж/моль.