Опыт 2. Зависимость скорости реакции от температуры
Исследуется полуэмпирическое правило Вант-Гоффа и уравнение Аррениуса, графическое решение которого позволяет определить энергию активации реакции.
Методика выполнения опыта
В три пробирки налейте по 2 мл раствора Na2S2O3, поставьте в стакан с горячей водой и через 3 – 5 минут измерьте температуру термометром. Добавьте в первую пробирку 1 мл раствора H2SO4 и отметьте время от момента добавления кислоты до появления первых признаков помутнения. Изменяя температуру системы (доливая холодную или горячую воду), проведите реакцию во второй и третьей пробирках. Результаты опыта внесите в таблицу и постройте график, откладывая по оси ординат относительную скорость, а по оси абсцисс – температуру (t, t + 10, t + 20).
Рассчитайте средний температурный коэффициент реакции:
 , если
, если 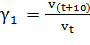 ;
;  .
.
Для графического расчета энергии активации постройте зависимость 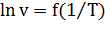 и по тангенсу угла наклона прямой определите энергию активации.
и по тангенсу угла наклона прямой определите энергию активации.