Основы атомно-молекулярного учения
При рассмотрении этой темы основное внимание уделить разделам:
1. Газовые законы;
2. Закон эквивалентов.
Усвоить основные понятия: моль, молярная масса, молярный объем газа, эквивалент, молярная масса эквивалента, молярный объем эквивалента вещества.
1. Состояние газа характеризуется его температурой T, давлением P и объемом V. Нормальные условия для газов P = 101,3 кПa = 1 атм = 760 мм. рт.ст., T
= 101,3 кПa = 1 атм = 760 мм. рт.ст., T = 00С = 273 K.
= 00С = 273 K.
Закон Авогадро: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Следствия из закона Авогадро:
I. Одинаковое число молекул различных газов при одинаковых физических условиях (T, P) занимает одинаковый объем.
Если число молекул равно числу Авогадро N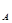 = 6,02∙10
= 6,02∙10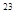 (1 моль газа), то при нормальных условиях они занимают объем 22,4 л (
(1 моль газа), то при нормальных условиях они занимают объем 22,4 л ( )
)
V 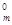 = 22,4 л/моль.
= 22,4 л/моль.
Плотность любого газа можно рассчитать по формуле 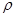 =
= 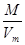 ,
,
где М - молярная масса газа (г/моль);
V - молярный объем газа (л/моль).
- молярный объем газа (л/моль).
II. Относительная плотность одного газа (1) по другому (2) равна отношению их молярных масс при заданном давлении и температуре:
D 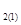 =
=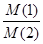
Относительная плотность газа по водороду D (Х) =
(Х) =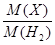 .
.
М (Х) = D (Х) ∙ М (Н
(Х) ∙ М (Н  ) =
) = 
Относительная плотность газа по воздуху D воздух (Х) =  .
.
М (Х) = D (Х)∙М (воздуха) = D воздух∙29
(Х)∙М (воздуха) = D воздух∙29
При низких температурах и высоких давлениях газы неидеальны и не подчиняются закону Авогадро.
Объединенный газовый закон:Для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная. 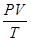 = const или
= const или 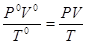
P0, V0, T0- соответственно давление, объем и температура данной массы газа при н. у.
Уравнение Менделеева – Клапейрона: PV =  RT
RT
P- давление газа; T- температура (К); V- объем газа; М(Х)- молярная масса газа (г/моль); m(х)- масса газа (г); R- универсальная газовая постоянная = 8,314 = 8,314
= 8,314 = 8,314
= 8,314  = 8,314 ∙10
= 8,314 ∙10
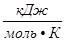 = 0,082
= 0,082 = 62,36
= 62,36  = 1,986
= 1,986  .
.
Закон Дальтона: Общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме давлений газов, составляющих смесь: P = p + p
+ p  + p
+ p +… + p n,
+… + p n,
где P- общее давление; p ,p
,p ,p
,p ,…,p n- парциальные давления газов 1,2,3,…,n.
,…,p n- парциальные давления газов 1,2,3,…,n.
Парциальным давлением газа в смеси называется давление, которое производил бы данный газ, если бы он один занимал весь объем, занимаемый смесью газов, при данной температуре.
Пример 1. Какой объем при н.у. занимают: а) 0,5 моль водорода; б) 32 г оксида азота (II)?
Решение: а) V (H
(H ) = n(H
) = n(H )∙V
)∙V (H
(H )
)
V (Н
(Н ) = 0,5моль∙22,4 л/моль = 11,2 л
) = 0,5моль∙22,4 л/моль = 11,2 л
б) n (NO) = ; n (NO) =
; n (NO) = ;
;
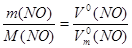 ; V
; V (NO) = 22,4 л/моль
(NO) = 22,4 л/моль
 M (NO) = 30 г/моль
M (NO) = 30 г/моль
V (NO) =
(NO) =  V
V (NO)
(NO)
V (NO) =
(NO) =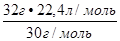 = 23,9 л
= 23,9 л
Ответ: V0(H2) = 11,2 л; V0(NO) = 23,9 л.
Пример 2. Вычислить объем, занимаемый 7 г оксида углерода (II) при 70C и 103974 Па.
Решение: Воспользуемся уравнением Менделеева – Клапейрона
P V
V =
= RT.
RT.
Откуда V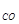 =
=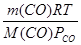 =
= =0,0056 м
=0,0056 м = 5,6 л
= 5,6 л
Ответ: VСО = 5,6л.
Пример 3. При температуре 27 С и давлении 2,5 атм газообразное вещество занимает объем 4,2 л. Вычислить объем газа при нормальных условиях.
С и давлении 2,5 атм газообразное вещество занимает объем 4,2 л. Вычислить объем газа при нормальных условиях.
Решение: Используем уравнение объединенного газового закона 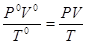 , откуда V
, откуда V =
=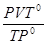 =
=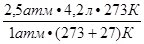 = 9,56 л.
= 9,56 л.
Ответ: V = 9,56 л.
Пример 4. Определить парциальные давления азота и кислорода в смеси объемом 7л, если общее давление в смеси равно 8,2МПа, а объемы смешиваемых газов равны 2л и 5л соответственно.
Решение: Объемные доли газов в смеси составляют 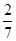 для азота и
для азота и  для кислорода. Следовательно, на долю азота приходится
для кислорода. Следовательно, на долю азота приходится 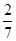 общего давления или 8,2 ∙
общего давления или 8,2 ∙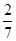 = 2,34 МПа, на долю кислорода- 8,2 ∙
= 2,34 МПа, на долю кислорода- 8,2 ∙ = 5,86 МПа, что и является их парциальными
= 5,86 МПа, что и является их парциальными давлениями в смеси.
давлениями в смеси.
Ответ: P (N2) = 2,34 MПа, P (O2) = 5,86 МПа.
Пример 5. При некоторой температуре приготовили 8 л газовой смеси из 4 л оксида серы (IV), находившегося под давлением 720 мм. рт. ст., 6 л азота, находившегося под давлением 640 мм. рт. ст. и 3 л кислорода, находившегося под давлением 816 мм. рт. ст.. Определить парциальные давления газов в смеси и общее давление газовой смеси.
Решение: Находим, что объем оксида серы увеличился в  =2 раза, объем азота – в
=2 раза, объем азота – в 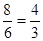 раза, объем кислорода – в
раза, объем кислорода – в  раза. Во столько же раз уменьшилось давление этих газов по сравнению с теми значениями, которые были до смешения. Находим парциальные давления газов в смеси:
раза. Во столько же раз уменьшилось давление этих газов по сравнению с теми значениями, которые были до смешения. Находим парциальные давления газов в смеси:
Р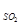 =720 мм. рт. ст. :2 = 360 мм. рт. ст.
=720 мм. рт. ст. :2 = 360 мм. рт. ст.
Р = 640 мм. рт. ст. :
= 640 мм. рт. ст. : 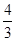 = 640 мм. рт. ст. ∙
= 640 мм. рт. ст. ∙ = 480 мм. рт. ст.
= 480 мм. рт. ст.
Р = 816 мм. рт. ст. :
= 816 мм. рт. ст. : = 816 мм. рт. ст. ∙
= 816 мм. рт. ст. ∙ = 306 мм. рт. ст.
= 306 мм. рт. ст.
По закону парциальных давлений находим давление газовой смеси:
P (cмеси) = Р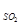 +P
+P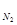 +P
+P = 360+480+306 = 1146 мм. рт. ст.
= 360+480+306 = 1146 мм. рт. ст.
Ответ: Рсмеси = 1146 мм. рт. ст.