Химическая кинетика
Выучитьпонятия:
1. скорость химической реакции: истинная и средняя
2. константа скорости химической реакции
3. порядок и молекулярность реакции
4. температурный коэффициент скорости реакции
5. энергия активации
Необходимо знать:
1. кинетические уравнения химических реакций разного порядка
2. зависимость константы скорости химической реакции от различных факторов
3. правило Вант-Гоффа
4. уравнение Аррениуса
5. связь между энтальпией реакции и энергией активации прямой и обратной реакций.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени (τ, с).
Для гомогенной реакции v = 
 [
[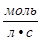 ]
]
Для гетерогенной реакции v = 
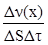 [
[ ]
]
Важнейшие факторы, влияющие на скорость химических реакций: природа и концентрация реагирующих веществ, температура процесса, наличие катализатора.
Зависимость скорости химической реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна действующим массам – молярным концентрациям реагирующих веществ, взятым в степени соответствующих стехиометрических коэффициентов (для простых реакций) или в степени определяемой опытным путем (для сложных реакций).
Например, для простой реакции aA + bB = cC + dD
v = kC C
C , n
, n = a + b
= a + b
для сложной реакции aA +bB = cC + dD
v = kC C
C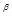 , n
, n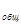 =
= 
Cумма показателей степеней в кинетическом уравнении называется общим порядком реакции (n).
Частный порядок или порядок по данному веществу определяется как показатель степени концентрации этого вещества:
для простой реакции n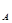 = a, n
= a, n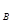 = b
= b
для сложной реакции n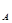 =
=  , n
, n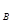 =
= 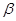
Порядок – эмпирический параметр, показывающий зависимость скорости реакции от концентрации реагентов. Он может принимать любые значения (целые, дробные, ноль, положительные, отрицательные).
Молекулярность реакции – число молекул одновременно участвующих в элементарном акте реакции. Принимает значения 1,2, 3. Определяется по самой медленной стадии процесса, без знания механизма реакции молекулярность определить невозможно.
В случае гетерогенных процессов в выражение закона действия масс не входит концентрация веществ, находящихся в конденсированной фазе, поскольку реакция протекает лишь на их поверхности.
Константа скорости реакции k – фундаментальный кинетический параметр, не зависящий от концентраций реагентов, а потому остающийся неизменным в течение реакции.
Константа скорости численно равна скорости химической реакции при концентрациях всех реагирующих веществ равных 1 моль/л.
Константа скорости зависит от природы реагирующих веществ, температуры, наличия в реакционной среде катализатора.
Зависимость скорости химической реакции от температуры выражается уравнением Вант-Гоффа: v = v∙
= v∙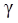
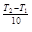
 ,
,
где v - cкорость реакции при температуре Т
- cкорость реакции при температуре Т ;
;
v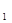 - cкорость реакции при температуре Т
- cкорость реакции при температуре Т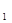 ;
;
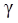 - температурный коэффициент скорости реакции, равный для
- температурный коэффициент скорости реакции, равный для
большинства гомогенных процессов 2 ~ 4.
Уравнение Вант-Гоффа показывает, что при повышении температуры на каждые 10 С скорость химической реакции возрастает в 2 ~ 4 раза.
С скорость химической реакции возрастает в 2 ~ 4 раза.
Более точную зависимость скорости химической реакции от температуры устанавливает уравнение Аррениуса:k = k e
e 
 ,
,
где k – константа скорости реакции при температуре Т; k - предэкспоненциальный множитель, пропорциональный числу столкновений реагирующих частиц; Е
- предэкспоненциальный множитель, пропорциональный числу столкновений реагирующих частиц; Е - энергия активации (кДж/моль) реакции, то избыточное количество энергии которым должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию; R – универсальная газовая постоянная, ее значение 8,314 ∙10-3
- энергия активации (кДж/моль) реакции, то избыточное количество энергии которым должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию; R – универсальная газовая постоянная, ее значение 8,314 ∙10-3 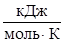 .
.
Уравнение Аррениуса для температурного интервала от  имеет следующий вид:
имеет следующий вид:
ln =
=  (
( ―
―  ) или lg
) или lg =
= 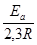 (
( ―
―  ),
),
где k - константа скорости реакции при температуре Т
- константа скорости реакции при температуре Т ; k
; k - константа скорости реакции при температуре Т
- константа скорости реакции при температуре Т .
.
На скорость химических реакций существенное влияние оказывают катализаторы – вещества, ускоряющие данную реакцию за счет образования промежуточных соединений с реагентами и выходящие из химического процесса без изменения. Уравнение Аррениуса для каталитического процесса имеет вид  =
=  = е
= е ,
,
где k - константа скорости каталитической реакции с энергией активации Е
- константа скорости каталитической реакции с энергией активации Е ; k – константа скорости некаталитической реакции с энергией активации Е
; k – константа скорости некаталитической реакции с энергией активации Е .
.
Пример 1. Определить порядок и молекулярность реакции
S O
O
 + 3I
+ 3I = 2SO
= 2SO
 + I
+ I
 , если её скорость описывается уравнением v = k∙C
, если её скорость описывается уравнением v = k∙C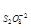 ∙С
∙С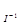 .
.
Решение: Зная, что порядок по веществу – это степень в которой находится концентрация данного вещества в выражении закона действия масс, находим порядок по каждому из участвующих в реакции веществ: n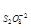 = 1, n
= 1, n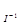 =1.
=1.
Общий порядок реакции n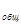 = n
= n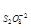 + n
+ n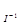 = 1 + 1 = 2.
= 1 + 1 = 2.
Молекулярность реакции определить невозможно, т.к. неизвестен механизм реакции.
Ответ: n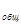 = 2, молекулярность определить невозможно по данным задачи.
= 2, молекулярность определить невозможно по данным задачи.
Пример 2.Реакция взаимодействия оксида азота (II) с кислородом имеет второй порядок по оксиду азота (II) и первый по кислороду. Указать общий порядок реакции и определить значение и размерность константы скорости, если при С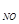 = 0,3 моль/л и С
= 0,3 моль/л и С = 0,15 моль/л скорость реакции составляет 1,2∙10
= 0,15 моль/л скорость реакции составляет 1,2∙10 моль/л∙с.
моль/л∙с.
Решение:Используя условие, записываем выражение закона действия масс v = k∙С ∙С
∙С . Общий порядок реакции равен 3 ( n
. Общий порядок реакции равен 3 ( n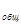 = n
= n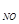 + n
+ n = 2 + 1 = 3). Константу скорости реакции рассчитываем по уравнению
= 2 + 1 = 3). Константу скорости реакции рассчитываем по уравнению
k =  =
=  = 8,89∙10
= 8,89∙10
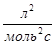 .
.
Ответ: n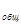 = 3, k = 8,89∙10
= 3, k = 8,89∙10
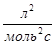
Пример 3.При 1500 С некоторая реакция заканчивается за 16 мин. Температурный коэффициент реакции равен 2,5. Через какое время закончится эта реакция при 80 С? Как изменится скорость реакции?
С? Как изменится скорость реакции?
Решение:Воспользуемся уравнением Вант-Гоффа
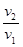 =
= 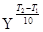 = 2,5
= 2,5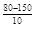 = 2,5
= 2,5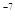 =
= 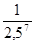 =
=  .
.
Cкорость реакции, при понижении температуры со 150 С до 80
С до 80 С, уменьшится в 610, 35 раз. Зная, что скорость реакции и время её протекания обратно пропорциональны, заменяем соотношение скоростей соотношением времен
С, уменьшится в 610, 35 раз. Зная, что скорость реакции и время её протекания обратно пропорциональны, заменяем соотношение скоростей соотношением времен  . Отсюда,
. Отсюда,  =
=  . t
. t = 610,35∙ t
= 610,35∙ t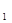 =610,35 ∙16 мин =
=610,35 ∙16 мин =
= 9765,6 мин = 162,76 ч = 6,78 сут.
Ответ: при 80 С реакция закончится через 6,78 суток; скорость реакции уменьшится в 610,35 раз.
С реакция закончится через 6,78 суток; скорость реакции уменьшится в 610,35 раз.
Пример 4.Определить, как изменится скорость прямой реакции
2СО +О
+О
 = 2СО
= 2СО
 , если общее давление в системе увеличить в 4 раза.
, если общее давление в системе увеличить в 4 раза.
Решение: Увеличение давления в системе в 4 раза вызовет уменьшение обьема системы в 4 раза, а концентрации реагирующих веществ возрастут в 4 раза. Согласно закону действия масс для гомогенных реакций начальная скорость реакции равна v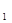 = k∙C
= k∙C ∙C
∙C . После увеличения давления
. После увеличения давления
v =k∙ (4C
=k∙ (4C )
)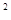 ∙4C
∙4C = k∙ 4
= k∙ 4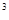 ∙C
∙C ∙C
∙C
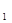 = 64 k ∙C
= 64 k ∙C ∙C
∙C .
.
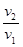 =
= 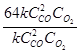 = 64.
= 64.
Ответ: после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Контрольные вопросы:
1. Что называют скоростью химической реакции? В чем отличие понятий средней и истинной скоростей реакции? Какова размерность скорости химической реакции?
2. Какова формулировка основного закона химической кинетики – закона действия масс?
3. Какие факторы влияют на скорость химической реакции? В чем заключается различие кинетики гомогенных и гетерогенных химических реакций?
4. Что такое константа скорости химической реакции, от каких факторов она зависит?
5. Что такое порядок и молекулярность химической реакции? Как на основе этих понятий классифицируются химические реакции? Что называется общим и частным порядком реакции?
6. Что отражает кинетическое уравнение реакции? Написать уравнения реакции I, II, III порядков.
7. Какова зависимость скорости реакции от температуры? Что такое температурный коэффициент скорости реакции, в каких пределах он изменяется?
8. Что такое энергия активации реакции? Написать выражение зависимости скорости реакции от температуры и энергии активации (уравнение Аррениуса).
9. Что такое катализ? Каковы представления о механизме катализа? Влияет ли на энергию активации процесса введение катализатора?
Задания для самостоятельного решения:
1. Записать выражение закона действия масс для данной реакции, указать общий порядок реакции и порядок по каждому, из участвующих в реакции, веществ. Как изменится скорость реакции при условии а и б.
| уравнение реакции | а | б | |
| 2NO(г)+ Сl2(г) = 2NOCl(г) | повысить P в 4 раза | понизить CNO в 50 раз | |
| 2CO(г) = CO2(г)+C(к) | понизить P в 5 раз | повысить C в 4 раза | |
| N2O4(г) = 2NО2(г) | повысить P в 8 раз | понизить C в 7 раз | |
| NO2(г)+CO(г) = NO(г)+CO2(г) | понизить P в 4 раза | повысить C в 80 раз | |
| Н2(г)+Cl(г) = HCl(г)+H(г) | повысить P в 2 раза | понизить C в 20 раз | |
| Cl2(г)+H(г) = HCl(г)+Cl(г) | понизить P в 7 раз | повысить C в 55 раз | |
| 2NO2(г) = N2O4(г) | повысить P в 10 раз | понизить C в 99 раз | |
| CaO(к)+СO2(г) = CаCO3(к) | понизить P в 6 раз | повысить C в 4 раза | |
| HCl(г) = Н(г)+Cl(г) | повысить P в 8 раз | понизить C в 12 раз | |
| NO(г)+О(г )= NO2(г) | понизить P в 9 раз | повысить C в 56 раз | |
| (CH3)2CO(г) = C2H6(г)+CO(г) | повысить P в 2 раза | понизить C в 98 раз | |
| 2H2O2(г)= 2H2O(г)+O2(г) | понизить P в 5 раз | повысить C в 65 раз | |
| 2NO(г)+O2(г) = 2NO2(г) | повысить P в 3 раза | понизить C в 2 раза | |
| С(графит)+O2(г) = CO2(г) | понизить P в 9 раз | повысить C в 9 раз | |
N2O5(г) = 2NO2(г)+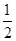 O2(г) O2(г)
| повысить P в 2 раза | понизить C в 5 раз |
2. Температурный коэффициент скорости реакции равен 3,2. Как изменится скорость реакции, если повысить температуру на 400?
3. Как следует изменить температуру, чтобы скорость реакции увеличилась в 8 раз (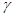 =2)?
=2)?
4. За какое время пройдет реакция при 600 С, если при 200 С она заканчивается за 40 с, а температурный коэффициент равен 2,3?
5. Вычислить температурный коэффициент скорости реакции, если понижение температуры на 40 К вызывает уменьшение скорости реакции в 140 раз.
6. При 1400 С реакция заканчивается за 30 с. Сколько времени потребуется для данной реакции при 200 С, если 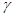 =2?
=2?
7. Температурный коэффициент скорости реакции равен 3. Как изменится скорость реакции при уменьшении температуры с 1250 до 550 С?
8. При повышении температуры на 200 С скорость реакции возросла в 9 раз. Чему равен температурный коэффициент этой реакции и во сколько раз увеличится ее скорость при повышении температуры с 200 до 1000 С?
9. Температурный коэффициент скорости реакции равен 2,5. Как изменится ее скорость: а) при охлаждении реакционной смеси от 500 до 300 С; б) при повышении температуры на 600 С?
10. При повышении температуры от 200 до 400 С скорость реакции увеличилась в 6 раз. Вычислить температурный коэффициент и энергию активации реакции.
11. Вычислить температурный коэффициент скорости реакции гидролиза сахарозы в кислом водном растворе (100-500 С), Еа = 107 кДж/моль.
12. Как изменится скорость реакции при повышении температуры с 600 до 650 К, если энергия активации равна 26,6 кДж/моль?
13. Как изменится скорость реакции при повышении температуры с 307 до 377 К, если энергия активации равна 186,8 кДж/моль?
14. Введением катализатора энергия активации реакции при 40 С снижена на 50 кДж/моль. Как изменится скорость реакции?
С снижена на 50 кДж/моль. Как изменится скорость реакции?
15. При 45 С реакция завершается за 150 с, а при 55
С реакция завершается за 150 с, а при 55 С – за 75 с . Вычислить энергию активации реакции.
С – за 75 с . Вычислить энергию активации реакции.
16. С выводом катализатора из системы, энергия активации реакции увеличилась на 30 кДж/моль при температуре 20 С. Как изменится скорость химической реакции?
С. Как изменится скорость химической реакции?
17. При 37 С реакция заканчивается за 150 с. Сколько потребуется времени для проведения этой реакции при 47
С реакция заканчивается за 150 с. Сколько потребуется времени для проведения этой реакции при 47  С, если энергия активации равна 57,2 кДж/моль?
С, если энергия активации равна 57,2 кДж/моль?
18. В присутствии катализатора энергия активации некоторой реакции снижается с 80 до 55 кДж/моль при температуре 20 С. Как изменится скорость реакции в этом случае?
С. Как изменится скорость реакции в этом случае?
19. Как изменится скорость реакции при понижении температуры с 50 С до 20
С до 20 С, если энергия активации равна 28,8 кДж/моль?
С, если энергия активации равна 28,8 кДж/моль?
20. Энергия активации разложения пероксида водорода составляет 75 кДж/моль. В присутствии коллоидной платины она уменьшается до 49 кДж/моль, а в присутствии каталазы до 23 кДж/моль. Во сколько раз изменяют скорость реакции обычный катализатор и фермент при 300К?
21. Как изменится скорость реакции при повышении температуру до 50 С, если энергия активации равна 125,5 кДж/моль?
С, если энергия активации равна 125,5 кДж/моль?
22. После удаления катализатора из системы, энергия активации реакции возросла на 40 кДж/моль при температуре 37 С. Как изменилась скорость реакции?
С. Как изменилась скорость реакции?
23. Реакция при 20 С завершается за 60 с. Сколько для этого потребуется времени при 40
С завершается за 60 с. Сколько для этого потребуется времени при 40 С, если энергия активации равна 33,4 кДж/моль?
С, если энергия активации равна 33,4 кДж/моль?
24. Введением катализатора, энергия активации реакции при 29 С снижена на 30 кДж/моль. Как изменилась скорость реакции?
С снижена на 30 кДж/моль. Как изменилась скорость реакции?
25. При повышении температуры с 20 до 50
до 50 С скорость реакции возросла в 3 раза. Чему равна энергия активации реакции?
С скорость реакции возросла в 3 раза. Чему равна энергия активации реакции?
26. Энергия активации реакции разложения некоторого вещества равна 
 75 кДж/моль, а обратной реакции – 265 кДж/моль. Рассчитайте температурный коэффициент скорости прямой реакции в интервале 600 – 800С и стандартную энтальпию реакции.
75 кДж/моль, а обратной реакции – 265 кДж/моль. Рассчитайте температурный коэффициент скорости прямой реакции в интервале 600 – 800С и стандартную энтальпию реакции.