Равновесия в растворах электролитов
Электролитами называют вещества, расплавы и растворы которых проводят электрический ток. Неэлектролиты электрический ток не проводят. Электролиты делят на две большие группы: cильные и слабые. Сильные электролиты в растворах ионизированы полностью
КА 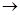 К
К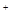 + А
+ А ; HNO
; HNO
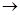 H
H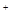 + NO
+ NO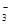 ,
,
а слабые – частично
KA 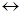 К
К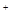 + А
+ А ; CH
; CH COOH
COOH 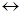 H
H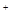 + CH
+ CH COO
COO .
.
Количественными характеристиками процесса диссоциации слабого электролита являются степень диссоциации  и константа диссоциации К
и константа диссоциации К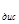
 =
= 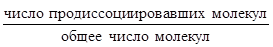 , (0≤
, (0≤ ≤1); К
≤1); К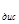 =
= 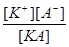 .
.
Cвязь между степенью диссоциации и константой диссоциации описывается уравнением Оствальда: К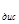 =
= 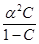 ,
,
где С – молярная концентрация электролита, моль/л.
Для очень слабых электролитов уравнение преобразуется в более простое К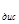 =
= 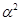 С, откуда
С, откуда 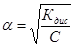 .
.
В растворах электролитов существует взаимное влияние ионов: одноименные по заряду ионы отталкиваются, а разноименные – притягиваются. В результате часть ионов оказывается в связанном состоянии. Это приводит к изменению свойств растворов, уменьшению концентрации кинетически самостоятельных частиц, как бы к снижению диссоциации электролита. Для количественного определения этого влияния используют величину ионной силы раствора (I):
I = 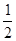 (C
(C z
z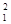 + C
+ C z
z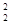 + … + C
+ … + C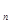 z
z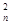 ),
), 
где С ,C
,C , …, C
, …, C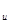 - молярные концентрации ионов в растворе, моль/л; z
- молярные концентрации ионов в растворе, моль/л; z ,z
,z ,…,z
,…,z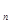 - заряды ионов, соответственно.
- заряды ионов, соответственно.
Ионная сила является аддитивной величиной, т.е. каждый электролит вносит свой вклад в величину I независимо от других.
Для каждого иона определенному значению ионной силы соответствует свой коэффициент активности f, который показывает, какая часть ионов от их общего числа находится в активном, т. е. несвязанном состоянии.
Состав растворов электролитов часто характеризуют эффективной концентрацией, называемой активностью (а). Активность связана с молярной концентрацией соотношением: a = f C. При уменьшении концентрации коэффициент активности f стремится к единице и, следовательно, активность практически равна молярной концентрации.
В растворах слабых электролитов, где значение ионной силы низкое, и для разбавленных растворов сильных электролитов, можно принять а = С.
Пример 1. Рассчитать, как изменится рН раствора гидроксида натрия с молярной концентрацией 0,05 моль/л при введении в него 0,05 моль/л хлорида натрия.
Решение:
а) Находим рН раствора чистой щелочи. Согласно уравнению диссоциации NaOH 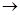 Na
Na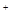 + OH
+ OH C
C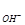 = C
= C 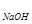 = 0,05 моль/л.
= 0,05 моль/л.
Ионная сила данного раствора:
I = 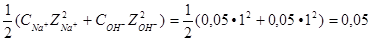 .
.
По таблице находим коэффициент активности для однозарядных ионов
f = 0,85. Тогда, а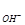 = f
= f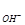 C
C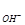 = 0,85∙0,05 = 0,0425 моль/л и
= 0,85∙0,05 = 0,0425 моль/л и
рОН = - lg a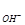 = - lg 0,0425 = 1,37, pH = 14 – pOH = 14 – 1,37 = 12,63.
= - lg 0,0425 = 1,37, pH = 14 – pOH = 14 – 1,37 = 12,63.
б) Рассчитаем рН после добавления в раствор щелочи соли хлорида натрия. Хлорид натрия диссоциирует полностью NaCl  Na
Na + Cl
+ Cl ,
,
давая в раствор 0,05 моль/л ионов Na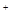 и 0,05 моль/л ионов Cl
и 0,05 моль/л ионов Cl . Следовательно, ионная сила такого раствора станет равной 0,1.
. Следовательно, ионная сила такого раствора станет равной 0,1.
I = 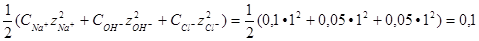
При такой ионной силе f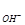 = 0,8 (см. таблицу).
= 0,8 (см. таблицу).
рOН = - lg a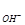 = - lg 0,8∙0,05 = - lg 0,04 =1,4; pH = 14 – pOH = 14 – 1,4 = 12,6
= - lg 0,8∙0,05 = - lg 0,04 =1,4; pH = 14 – pOH = 14 – 1,4 = 12,6
Таким образом, рН уменьшится с 12,63 до 12,6.
Ответ: рН уменьшится с 12,63 до 12,6
Пример 2. Вычислить концентрацию ионов водорода Н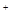 и степень диссоциации уксусной кислоты в растворе с молярной концентрацией эквивалента кислоты 0,001 моль/л.
и степень диссоциации уксусной кислоты в растворе с молярной концентрацией эквивалента кислоты 0,001 моль/л.
Решение:Уксусная кислота - слабый электролит
СH COOH
COOH 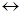 H
H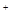 + CH
+ CH COO
COO .
.
C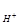 =
=  C
C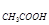 ,
,  =
= 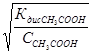 , K
, K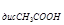 = 1,8∙10
= 1,8∙10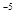 ,
,
 =
= 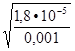 = 0,134, C
= 0,134, C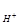 = 0,134∙0,001 = 1,34∙10
= 0,134∙0,001 = 1,34∙10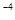 моль/л.
моль/л.
Ответ: C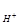 = 1,34∙10
= 1,34∙10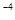 моль/л.;
моль/л.;  = 0,134
= 0,134
Пример 3. Выпадет ли осадок при смешивании равных объемов сульфата марганца с С(MnSO ) = 0,01 моль/л и раствора сульфида аммония с С((NH
) = 0,01 моль/л и раствора сульфида аммония с С((NH )
) S) = 0,02 моль/л?
S) = 0,02 моль/л?
Решение:MnSO + (NH
+ (NH )
) S = MnS
S = MnS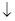 + (NH
+ (NH )
) SO
SO
Осадок будет образовываться только в том случае, если [Mn ]∙[S
]∙[S ] > ПР
] > ПР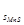 .
.
При сливании равных объемов растворов концентрации уменьшились вдвое, т.е. концентрация сульфата марганца стала 0,005 моль/л, а концентрация сульфида аммония – 0, 01 моль/л.
MnSO
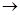 Mn
Mn +SO
+SO , (NH
, (NH )
) S
S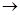 2NH
2NH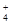 + S
+ S ,
,
[Mn ] = [MnSO
] = [MnSO ] = 0,005 моль/л, [S
] = 0,005 моль/л, [S ] = [(NH
] = [(NH )
) S] = 0,01 моль/л,
S] = 0,01 моль/л,
[Mn ]∙[S
]∙[S ] = 0,005∙0,01 = 5∙10
] = 0,005∙0,01 = 5∙10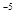 , ПР
, ПР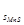 = 1,1∙10
= 1,1∙10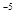 ( cправочная величина ),
( cправочная величина ),
[Mn ]∙[S
]∙[S ] > ПР
] > ПР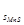 , осадок будет выпадать.
, осадок будет выпадать.
Ответ: осадок будет выпадать
Пример 4. Можно ли приготовить раствор гидроксида кальция с молярной концентрацией 0,002 моль/л?
Решение: Определим молярную концентрацию ионов в заданном растворе из уравнения диссоциации Ca(OH)
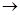 Ca
Ca + 2OH
+ 2OH ,
,
[Ca+2] = C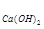 = 2∙10
= 2∙10 моль/л, [OH-1] = 2С
моль/л, [OH-1] = 2С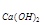 = 2∙2∙10
= 2∙2∙10 = 4∙10
= 4∙10 моль/л,
моль/л,
[Ca+2][OH-1]2 = 2∙10-3(4∙10-3)2 =32∙10-9 =3,2∙10-8
Полученная величина произведения концентраций меньше справочного значения константы растворимости ( K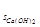 = 6 ∙10-6) следовательно, вещество растворится полностью и раствор с С (Са(ОН)
= 6 ∙10-6) следовательно, вещество растворится полностью и раствор с С (Са(ОН) ) = 0,002 моль/л приготовить можно.
) = 0,002 моль/л приготовить можно.
Ответ: можно
Пример 5. Рассчитать константу гидролиза сульфида натрия по двум ступеням и сделать вывод о возможности протекания гидролиза по второй ступени при комнатной температуре.
Решение: В водном растворе сульфид натрия полностью диссоциирует на ионы Na S
S 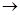 2Na
2Na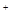 + S
+ S . Данная соль образована сильным основанием NaOH и слабой кислотой H
. Данная соль образована сильным основанием NaOH и слабой кислотой H S, поэтому в реакцию с водой вступает S
S, поэтому в реакцию с водой вступает S .
.
Многозарядные ионы гидролизуются ступенчато:
S + Н
+ Н О = HS
О = HS + OH
+ OH (первая ступень гидролиза)
(первая ступень гидролиза)
HS + Н
+ Н О = H
О = H S + OH
S + OH (вторая ступень гидролиза).
(вторая ступень гидролиза).
Для первой ступени К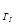 =
= =
= 
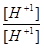 =
= 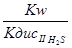 =
=
= 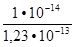 = 8,13 ∙ 10-2
= 8,13 ∙ 10-2
Для второй ступени К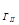 =
= 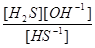 =
= 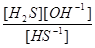
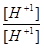 =
= 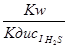 =
=
= 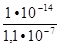 = 9 ∙ 10-8
= 9 ∙ 10-8
К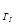 >>К
>>К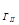 , что свидетельствует о том, что по второй ступени гидролиз практически не идет при комнатной температуре. Для сдвига равновесия в сторону усиления гидролиза следует повышать температуру и разбавлять раствор.
, что свидетельствует о том, что по второй ступени гидролиз практически не идет при комнатной температуре. Для сдвига равновесия в сторону усиления гидролиза следует повышать температуру и разбавлять раствор.
Ответ: вторая ступень гидролиза практически
не идет при комнатной температуре
Пример 6. Рассчитать рН водного раствора хлорида алюминия с молярной концентрацией 0,01 моль/л.
Решение: В растворе соль полностью диссоциирует на ионы AlCl
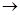 Аl
Аl +3Cl
+3Cl . Соль, образованна слабым основанием Al(OH)
. Соль, образованна слабым основанием Al(OH) и сильной кислотой HCl, поэтому гидролиз идет по катиону Al
и сильной кислотой HCl, поэтому гидролиз идет по катиону Al .
.
При комнатной температуре гидролиз протекает по первой ступени
Al + H
+ H O
O = AlOH
= AlOH + H
+ H , среда кислая, рН < 7
, среда кислая, рН < 7
К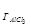 =
=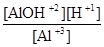 =
= 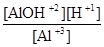
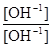 =
=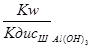 =
= 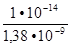 =
=  7,25∙
7,25∙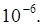
Поскольку значение константы гидролиза К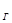 мало, оценим степень гидролиза по формуле
мало, оценим степень гидролиза по формуле 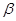 =
= 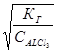 =
= 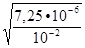 =
= 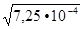 = 2,7∙10
= 2,7∙10
Концентрацию Н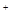 , образующихся в результате гидролиза соли, находим по формуле: С
, образующихся в результате гидролиза соли, находим по формуле: С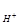 =
= 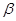 С(соль) = 2,7∙10-2∙10 -2= 2,7∙10
С(соль) = 2,7∙10-2∙10 -2= 2,7∙10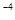 (моль/л).
(моль/л).
Откуда рН = - lg C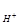 = - lg 2,7∙10
= - lg 2,7∙10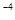 = - lg 2,7 + (- lg 10
= - lg 2,7 + (- lg 10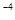 ) = - 0,43 + 4 = 3,57.
) = - 0,43 + 4 = 3,57.
Ответ: среда кислая, рН = 3,57
Задания для самостоятельного решения:
Из четырех веществ выбрать сильные и слабые электролиты и составить уравнение диссоциации их в водном растворе.
1. Рассчитать рН растворов электролитов из столбцов 1 и 2 для соответствующих концентраций, данных в столбцах 1а и 2а. Для раствора сильного электролита определить ионную силу раствора и активность катионов и анионов. Для раствора слабого электролита рассчитать степень диссоциации по приближенной формуле Оствальда. Написать выражение для констант диссоциации слабого электролита по всем возможным ступеням.
2. В столбце 3 приведены малорастворимые электролиты. Написать выражение константы растворимости для малорастворимого электролита. Определить, можно ли приготовить раствор этого электролита молярной концентрации, указанной в столбце 3а.
3. Написать уравнение гидролиза соли, данной в столбце 4, по всем возможным ступеням и выражение для констант гидролиза по этим ступеням. Рассчитать рН раствора соли, учитывая только первую ступень гидролиза (концентрация соли указана в столбце 4а). Указать реакцию среды раствора. Определить, как будет изменяться рН раствора при нагревании и почему?
| формула вещества | ||||||||
| 1а | 2а | 3а | 4а | |||||
| NaOH | H2SO3 | AgCl | MnI2 | 0,06 | 0,0001 | 3∙10
| 0,04 | |
| HCl | NH4OH | PbSO4 | Zn(NO3)2 | 0,01 | 0,002 | 7∙10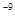
| 0,001 | |
| LiOH | H2CO3 | CdS | FeCl3 | 0,04 | 0,009 | 1∙10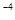
| 0,05 | |
| HNO3 | HNO2 | CaF2 | КCN | 0,007 | 0,01 | 1∙10
| 0,004 | |
| HBr | H3BO3 | Ag2S | NaHCO3 | 0,05 | 0,03 | 2∙10
| 0,01 | |
| KOH | H2Se | BaSO4 | CuBr2 | 0,001 | 0,09 | 4∙10
| 0,008 | |
| H2SO4 | NH4OH | PbCl2 | (NH4)2SO4 | 0,005 | 0,1 | 9∙10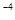
| 0,02 | |
| HClO4 | HClO | ZnS | Na2S | 0,03 | 0, 002 | 1∙10-1 | 0,001 | |
| Ba(OH)2 | H3PO4 | PbI2 | Ni(NO3)2 | 0,004 | 0,08 | 7∙10-2 | 0,12 | |
| RbOH | H2S | Ag3PO4 | K2SiO3 | 0,7 | 0,0002 | 6∙10-4 | 0,05 | |
| HNO3 | HCOOH | Fe2S3 | NH4Cl | 0,002 | 0,0001 | 5∙10-8 | 0,007 | |
| HI | H2SiO3 | Cu2S | Na3PO4 | 0,06 | 0,07 | 2∙10-1 | 0,2 | |
| Sr(OH)2 | HCN | MgCO3 | FeCl3 | 0,009 | 0,0005 | 9∙10-7 | 0,03 | |
| H2SO4 | NH4OH | Sn(OH)2 | Ba(NO2)2 | 0,05 | 0,025 | 3∙10-2 | 0,001 | |
| KOH | HF | Ag2CrO4 | Al2(SO4)3 | 0,007 | 0,004 | 6∙10-5 | 0,01 |
