Коррозия металлов
Коррозиейназывают процесс самопроизвольного окисления металла в результате его физико-химического взаимодействия с окружающей средой (ΔG < 0). По механизму протекания различают:
а) химическую коррозию в средах, не проводящих электрический ток (газовая коррозия, коррозия в неэлектролитах);
б) электрохимическую коррозию в средах, имеющих ионную проводимость (коррозия в электролитах, в атмосфере влажного воздуха, в почве).
При электрохимической коррозии разрушение металла происходит в результате работы огромного количества коррозионных микроэлементов. При этом на более активном металле, с меньшим значением потенциала, протекает анодная реакция (окисление), а на участках металла с большим значением потенциала – катодное восстановление окислителя:
A: Me – ne = Me+n
K: O2 + 2H2O + 4e = 4OH-1 (pH > 7) кислородная деполяризация
O2 + 4H+1 + 4e = 2H2O (pH < 7)
2H2O + 2e = H2 + 2OH-1 (pH > 7) водородная деполяризация
2H+1 + 2e = H2 (pH < 7)
Возможность протекания коррозии может быть определена по знаку ЭДС коррозионного элемента Е = φкатод – φанод или Е = φокисл. – Евосстан.. Коррозия возможна, если Е > 0.
Равновесный потенциал кислородного электрода при 298 К описывается уравнением φ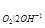 = 1,227 + 0,0147lg P
= 1,227 + 0,0147lg P - 0,059 pH, а потенциал водородного электрода определяется уравнением φ
- 0,059 pH, а потенциал водородного электрода определяется уравнением φ = - 0,059pH – 0,0295lg P
= - 0,059pH – 0,0295lg P .
.
Пример 1.Какие из металлов (Au, Sn, Mn) могут быть окислены кислородом при 298 К, рН = 7 и стандартных состояниях всех веществ?
Решение:Окисление металла возможно при условии φокисл. > φвосст., т.е. φ > φ
> φ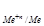 .
.
Потенциал кислородного электрода при 298 К, P = 1атм и рН = 7 равен 0,814 B. φ
= 1атм и рН = 7 равен 0,814 B. φ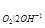 = 1,227 + 0,0147 lg 1 – 0,059∙7 = 0,814(B)
= 1,227 + 0,0147 lg 1 – 0,059∙7 = 0,814(B)
Стандартные потенциалы металлов равны φ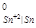 = - 0,136 B, φ
= - 0,136 B, φ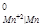 = - 1,18 B и φ
= - 1,18 B и φ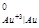 = 1,5 B. Отсюда следует, что указанное выше условие соблюдается для олова и марганца, которые могут быть окислены кислородом при рН = 7.
= 1,5 B. Отсюда следует, что указанное выше условие соблюдается для олова и марганца, которые могут быть окислены кислородом при рН = 7.
Ответ: олово и марганец могут быть окислены.
Пример 2. Рассмотрите коррозию изделия из алюминиевой бронзы: а) в дистиллированной воде; б) в сильнощелочной аэрированной среде (раствор гидроксида натрия). Предложите протектор для защиты изделия из алюминиевой бронзы от коррозии во влажном воздухе. Приведите уравнения протекающих процессов.
Решение: Алюминиевая бронза – сплав меди с алюминием.
Так как φ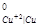 = 0,34 B > φ
= 0,34 B > φ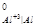 = - 1,7 B, то зерна меди будут катодными участками, а алюминия – анодными участками. Последние и будут подвергаться коррозии. Катодные процессы определяются характером коррозионной среды.
= - 1,7 B, то зерна меди будут катодными участками, а алюминия – анодными участками. Последние и будут подвергаться коррозии. Катодные процессы определяются характером коррозионной среды.
а) Протекает коррозия с водородной деполяризацией
 А: Al – 3e = Al+3 2
А: Al – 3e = Al+3 2
К: 2H2O + 2e = H2 + 2OH-1 3
 2Al + 6H2O = 3H2 + 2Al(OH)3,.
2Al + 6H2O = 3H2 + 2Al(OH)3,.
б) Протекает коррозия с кислородной деполяризацией
 A: Al – 3e = Al+3 4
A: Al – 3e = Al+3 4
K: O2 + 2H2O + 4e = 4OH-1 3
 4Al +3O2 + 6H2O = 4 Al(OH)3
4Al +3O2 + 6H2O = 4 Al(OH)3
Al(OH)3 + NaOH = Na[Al(OH)4].
 Протектор, согласно принципу его действия, должен иметь потенциал более отрицательный, чем потенциал меди и алюминия, например магний (φ
Протектор, согласно принципу его действия, должен иметь потенциал более отрицательный, чем потенциал меди и алюминия, например магний (φ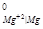 = - 2,37 В). В образующемся гальваническом элементе он будет выступать в качестве анода и разрушаться.
= - 2,37 В). В образующемся гальваническом элементе он будет выступать в качестве анода и разрушаться.
A: Mg – 2e = Mg+2 2
K: O2 + 2H2O + 4e = 4OH-1 1
 2Mg + O2 + 2H2O = 2Mg(OH)2
2Mg + O2 + 2H2O = 2Mg(OH)2
Пример 3.К какому типу покрытий относятся олово на меди и на железе? Какие процессы будут протекать при коррозии указанных пар в кислой среде?
Решение: φ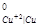 = 0,34 B; φ
= 0,34 B; φ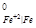 = - 0,44 B; φ
= - 0,44 B; φ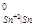 = - 0,14 B.
= - 0,14 B.
а) Т. к. φ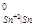 = - 0,14 B < φ
= - 0,14 B < φ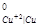 = 0,34 B, значит олово является анодным покрытием на меди. При коррозии разрушается металл покрытия:
= 0,34 B, значит олово является анодным покрытием на меди. При коррозии разрушается металл покрытия:
A: Sn – 2e = Sn+2
K: 2H+1 + 2e = H2
Sn + 2H+1 = Sn+2 + H2
б)Т. к. φ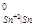 = - 0,14 B > E
= - 0,14 B > E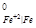 = - 0,44 B, значит олово является катодным покрытием железа. При нарушении целостности покрытия корродировать будет основной металл – железо.
= - 0,44 B, значит олово является катодным покрытием железа. При нарушении целостности покрытия корродировать будет основной металл – железо.
A: Fe – 2e = Fe+2
K: 2H+1 + 2e = H2
Fe + 2H+1 = Fe+2 + H2
Задания для самостоятельного решения:
1. Коррозия – процесс самопроизвольного разрушения металлов вследствие физико-химического взаимодействия с окружающей средой. Изменение свободной энергии Гиббса в этом случае: а) ΔG > 0; б) ΔG = 0; в) ΔG < 0.
2. Какой из процессов протекает на корродирующем металле:
а) Me+n +ne = Me восстановление;
б) Me – ne = Me+n восстановление;
в) Me – ne = Me+n окисление.
3. Какие процессы возможны при коррозии в кислой среде на катодных участках:
а) O2 + 2H2O + 4e = 4OH-1; в) H2 + 2OH-1 + 2e = 2H2O;
б) 2H+1 + 2e = H2; г) O2 + 4H+1 +4e = 2H2O.
4. Какие процессы возможны при коррозии в щелочной среде на катодных участках:
а) O2 + 2H2O + 4e = 4OH-1; в) H2 + 2OH-1 + 2e = 2H2O;
б) 2H+1 + 2e = H2; г) O2 + 4H+1 +4e = 2H2O.
5. Склепаны два металла. Какой из металлов будет подвергаться коррозии:
а) Zn – Fe; ж) Cu – Cd;
б) Pb – Sn; з) Ag – Pb;
в) Zn – Ag; и) Al – Ni;
г) Al – Fe; к) Fe – Sn;
д) Pd – Mn; л) Fe – Cd;
е) Fe – Ni; м) Сr – Ni.
6. Составьте уравнения электродных процессов, происходящих при коррозии вышеуказанных пар металлов:
а) в атмосфере влажного воздуха;
б) в дистиллированной воде;
в) в кислой среде.
7. Приведите примеры катодных и анодных покрытий для
а) меди; ж) железа;
б) никеля; з) свинца;
в) цинка; и) олова;
г) хрома; к) кадмия;
д) серебра; л) алюминия;
е) марганца; м) кобальта.
8. Возможна ли электрохимическая коррозия:
а) Sn в водном растворе при рН = 6 в контакте с воздухом;
б) Zn в дистиллированной воде;
в) Fe в атмосфере влажного воздуха;
г) Cu в деаэрированном растворе при рН = 2;
д) Cd в аэрированном растворе при рН = 10;
е) Fe в нейтральной среде рН = 7;
ж) Ni в водном растворе при рН = 1;
з) Pb в морской воде (рН = 8) в контакте с воздухом;
и) Al в деаэрированном растворе при рН = 3;
Приведите уравнения электродных процессов
Список литературы:
1. Основная литература:
1. Глинка, Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка; под ред: А.И. Ермакова – 30-е изд., испр. – М.: Интеграл-Пресс, 2009 – 727 с. – 57 экз.
2. Коровин, Н.В. Общая химия: учеб. для студ. учреждений высш. проф. образования/ Н.В. Коровин. – 13-е изд. перераб и доп. – М.: Издательский центр «Академия», 2011. – 496 с. – (Сер. Бакалавриат). ‑ 56 экз.
3.Глинка, Н.Л. Сборник задач и упражнений по общей химии: учеб. пособие для студ. нехимических спец. вузов / Н.Л. Глинка; под ред. В.А Рабиновича, Х.М. Рубининой – М.: Интеграл-Пресс, 2009.- 240 с.– 65 экз.
4. Хаускрофт, К. Современный курс общей химии: в 2 т. / К. Хаускрофт, Э. Констебл; пер. с англ. Я.А. Ребане и др.; под ред. В.П. Зломанова – М: Мир, 2009. Т. 1. – 539с. – 10 экз.
5. Хаускрофт, К. Современный курс общей химии: в 2 т. / К. Хаускрофт, Э. Констебл; пер. с англ.Р.В. Ничипорук, А.А. Молодыка; под ред. В.П. Зломанова – М: Мир, 2009. Т. 2. – 528с. –
10 экз.
2. Дополнительная литература:
1. Некрасов, Б.В.Основы общей химии: в 2-х т. / Б.В. Некрасов. – 4‑е изд., стереотип. – СПб. и др. – Т. 1. – 2003-.656 с.
2. Некрасов, Б.В.Основы общей химии: в 2-х т. / Б.В. Некрасов. – 4‑е изд., стереотип. – СПб. и др. – Т. 2. – 2003-.688 с.
3. Угай, Я.А. Общая и неорганическая химия: учеб. для вузов /Я.А. Угай – Изд. 5, стер. – М.: Высша. шк., 2007.-526 с.
4. Коровин, Н.В. Задачи и упражнения по общей химии: учеб. пособие / Под ред. Н.В. Коровина. – 3-е изд., испр. – М.: Высша. шк., 2006. – 255с.
5. Вольхин, В.В. Общая химия. Основной курс: учеб. пособие / В.В. Вольхин. – 2-е изд., перераб. и доп. – СПб.; М.; Крастнодар: Лань, 2008. – 464 с.
6. Вольхин, В.В. Общая химия. Избранные главы: учебн. пособие / В.В. Вольхин. – 2-е изд., перераб. и доп. – СПб.; М.; Крастнодар: Лань, 2008. – 384 с.
7. Ахметов, Н.С. Общая и неорганическая химия: учебн. для вузов/ Н.С. Ахметов. – 7-е изд., стер. – М.: Высш. шк., 2009. – 743 с.
8. Задачи и упражнения по общей химии: учебн. пособие для студ. вузов, обуч. по техническ им напр. и спец. / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др. Под ред. Н.В. Коровина. – 3-е изд., испр. – М.: Высшая школа, 2006. – 254с.
9. Гельфман, М.И. Химия: учебник для студ. вузов, обуч. по техническим спец. и напр. / М.И. Гельфман, В.П. Юстратов. – 4-е изд. стер. – СПб.; М.; Краснодар: Лань, 2008. – 472 с.
10. Теоретические основы общей химии: учеб. для студ.в вузов, обуч. по напр. подгот. диплом. спец. в обл. техники / А.И. Горбунов, А.А. Гуров, Г.Г. Филиппов, В.Н. Шаповал. – М.: Изд-во МГТУ им. Н.Э.Баумана, 2001. – 719 с.
11. Романцева, Л.М. Сборник задач и упражнений по общей химии: учеб пособие для нехимических спец. вузов / Л.М. Романцева, З.Л. Лещинская, В.А. Суханова.2-е изд., рераб и доп. – М.: Высш. шк., 1991. – 228 с.
12. Воюцкий, С.С. Курс коллоидной химии: учеб. пособие для хим.-технол. спец. вузов. / С.С. Воюцкий. – 2-е изд., перераб. и доп. – М.: Химия, 1976. - 512 с.
13. Жилин, Д.М. Общая химия. Практикум L-микро. Руководство для студентов / Д.М. Жилин. – М.: Изд-во МГИУ, 2006. – 321 с.
14. Жмурко Г.П. Лекции по общей и неорганической химии для студента первого курса биологического факультета (общий поток) [Электронный ресурс]: Химический факультет МГУ. Учебные материалы для нехимических специальностей. / Режим доступа:
http://www.chem.msu.su/rus/teaching/general.html.
16. Хлебников А.И., Аржанова И.Н., Напилкова О.А. Общая химия. Гипертекстовое учебное пособие [Электронный ресурс]:Факультет пищевых и химических производств АлтГТУ. Учебные материалы / Режим доступа: http://www.chem-astu.ru/chair/study/genchem/index.html
3. Справочная литература:
1.. Рябин, В.А. Термодинамические свойства веществ: справочник / В.А. Рябин, М.А. Остроумов, Т.Ф. Свит – Ленинград: Химия, 1977 –
392 с.
2. Лурье, Ю.Ю. Справочник по аналитической химии / Ю.Ю. Лурье. – 6-е изд., перераб. и доп. – М.: Химия, 1959. – 447 с.
3. Краткий справочник физико-химических величин / ред., сост. А.А. Равдель, ред., сост А.М. Пономарева, сост. Н.М. Барон, сост. З.Н. Тимофеева – 9-е изд. – СПб.: Специальная литература,1999. – 231 с.

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Дальневосточный федеральный университет»
(ДВФУ)
