I. Атомно-молекулярное учение
1. Для газов нормальными условиями считаются:
а) 101,3 кПа, 273 К; б) 1 кПа, 00 С; в) 100 Па, 250 С.
2. Значение универсальной газовой постоянной R в международной системе единиц СИ равно:
а) 8,314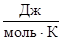 ; б) 62,36
; б) 62,36  ; в) 0,082
; в) 0,082 .
.
3. Какой из газов занимает наибольший объем при одинаковых условиях, если их массы равны?
а) Н2, M(H2) = 2 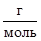 ; б) H2S, M(H2S) = 34
; б) H2S, M(H2S) = 34 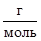 ; в) SO2, M(SO2) = 64
; в) SO2, M(SO2) = 64 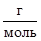 .
.
4. Смесь, состоящая из 3 моль O2 и 7 моль N2, при нормальных условиях занимает объем:
а) 224 л; б) 22,4 л; в) 11,2 л.
5. Число молекул, содержащихся в смеси, состоящей из 0,1 моль хлора и 0,9 моль водорода равно
а) 6,23 ∙ 1023; б) 1,5 ∙ 1025; в) 2,28 ∙ 1024.
6. Какие газы с указанной массой занимают равные объемы при одинаковых условиях:
а) 8 г О2 и 1 г He; б) 17 г NH3 и 22 г CO2; в) 22 г CO2 и 8 г О2;
M(O2)= 32 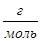 ; M(NH3)= 17
; M(NH3)= 17 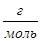 ; M(CO2) = 44
; M(CO2) = 44 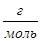 ; M(He) = 4
; M(He) = 4 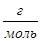 .
.
7. Какова формула газа, если относительная плотность газа по водороду равна 22?
а) СО2; б) O2; в) NH3.
8. Какова относительная молекулярная масса газа, если этот газ тяжелее воздуха в 2,2 раз (М(воздуха) = 29 г/моль)
а) 63,8; б) 26,1; в) 58.
9. В каком из приведенных соединений массовая доля кислорода составляет 50 % ?
а) SO2; б) CO; в) H2O2.
10. В кристаллогидрате сульфата кальция число атомов кислорода в 1,5 раза больше числа атомов водорода. Формула кристаллогидрата:
а) CaSO4 ∙2H2O; б) 2CaSO4 ∙H2O; в) CaSO4 ∙H2O.
11. В кристаллогидрате сульфата меди число атомов кислорода в 9 раз больше числа атомов серы. Формула кристаллогидрата:
а) CuSO4 ∙5H2O; б) CuSO4 ∙H2O; в) CuSO4 ∙2H2O.
12. В окислительно-восстановительной реакции 8HJ + H2SO4 (к) = 4J2 + H2S + 4H2O значение молярной массы эквивалента серной кислоты равно:
а) 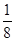 98 г/моль; б)
98 г/моль; б)  98 г/моль; в)
98 г/моль; в) 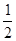 98 г/моль.
98 г/моль.
13. Определите фактор эквивалентности серы в оксиде серы (VI)
а)  ; б)
; б) 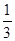 ; в) 2.
; в) 2.
14.Для какого вещества указанные величины соответствуют молярной массе эквивалента:
а) 32,5 г/моль Zn; б) 5,6 г O2; в) 11,2 л/моль H2.
15. Для какого вещества указанные значения объема (при н.у.) соответствуют молярному объему эквивалента:
а) 5,6 л О2; б) 22,4∙10-3 м3 H2; в) 11,2 л HCl.
16. Какова молярная масса эквивалента Al(OH)2Cl в реакции взаимодействия с эквимолекулярным количеством хлороводорода?
а) 96,5 г/моль; б) 48,25 г/моль; в) 32,2 г/моль.
17. При синтезе аммиака N2 + 3H2 = 2NH3 в реакцию вступило 15 л азота N2 и 45 л водорода Н2. В результате образовалось аммиака:
а) 30 л; б) 15 л; в) 45 л.
18. При взаимодействии 0,1 моль углерода с кислородом объемом 11,2 л (н.у.) образуется углекислый газ CO2 объемом (С + O2 = CO2):
а) 2,24 л; б) 5,6 л; в) 11,2 л.
19. Вычислить молярную массу эквивалента мышьяка и составить формулу сульфида мышьяка, если вещество содержит 39 массовых долей серы и мышьяк. Молярная масса эквивалента серы равна 16 г/моль.
а) 25 г/моль, As2S3; в) 15 г/моль, As2S5; в) 75 г/моль, AsS.
20. Определите молярную массу эквивалента металла, если на растворение 1,686∙10 – 2 кг металла потребовалось 1,47∙10 – 2 кг серной кислоты. Молярная масса эквивалента серной кислоты равна 49 г/моль.
а) 56,3 г/моль; б) 51,3 г/моль; в) 112,4 г/моль.