VII. Растворы электролитов
1. Чему равна концентрация ионов калия в 0,1 М растворе сульфита калия, если степень диссоциации соли равна 0,75?
а) 0,15 М; б) 1,5 М; в) 0,75 М.
2. Какова концентрация ионов водорода в 0,1 М растворе HCN, если константа диссоциации кислоты равна 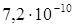 ?
?
а) М; б)
М; б)  М; в)
М; в) 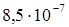 М.
М.
3. Рассчитать степень диссоциации и константу диссоциации в 0,06 М растворе слабого бинарного электролита, если 0,055 М молекул остались недиссоциированными.
а) 8,3 %; 4,1∙10-4 ; б) 9 %; 4,9∙10-4 ; в) 92 %; 5,1∙10-2 .
4. Что такое pH раствора?
а) pH = - lg [Н+]; б) pH = lg [Н+]; в) pH = - lg [ОH–].
5. Если pH изменится на две единицы, во сколько раз изменится концентрация ионов водорода?
а) в 102 раз; б) в два раза; в) в 0,5 раза.
6. У какого из растворов наибольшее значение pH?
а) [ОH–] = 10-4 М; б) [Н+] = 10-7 М; в) [ОH–] = 10-7 М.
7. Чему равна концентрация ионов водорода, если в растворе рН = 10?
а) 10-10 М; б) 10-7 М; в) 10-4 М.
8. Чему равен рОН в 5* 10-4 М растворе Н2SO4 ?
а) 11; б) 3; в) 7.
9. Определить степень диссоциации NaOH в 0,01 М растворе, если рН раствора равен 11,97.
а) 0,93; б) 0,95; в) 0,98.
10. Чему окажется равен pH, если смешать равные объемы 0,005 М раствора гидроксида натрия и 0,01 М раствора азотной кислоты?
а) 2,6; б) 2,85; в) 9,7.
11. Определите произведение растворимости карбоната бария, если в 100 мл насыщенного раствора его при 250 С содержится 1,38∙10-3 г соли. М BaCO3 = 197.
а) 4∙10-9; б) 7∙10-5; в) 4∙10-4.
12. Чему равна растворимость оксалата бария в воде в моль/л, если его произведение растворимости при 25 0С равно 1,5∙10-7 .
а) 4∙10-4; б) 4∙10-5; в) 4∙10-6.
13. Определить концентрацию ионов Cа2+ в моль/л и мг/л в насыщенном растворе СаСO3, если ПР СaCO3 = 4,8∙10-9 .
а) 6,9∙10-5 М; 6,9 мг/л; б) 8,5∙10-5 М; 5,9 мг/л; в) 8,5∙10-7 М; 6,9 мг/л.
14. В каком объеме можно растворить 1 г СаСO3 с образованием насыщенного раствора если ПР сaCO3 = 4,8∙10-9 ?
а) 144,9 л; б) 156,7 л; в) 123,5 л.
15. Рассчитать произведение растворимости ВаSO4, если для получения 0,5 л насыщенного раствора его требуется 1,16∙10-3 г ВаSO4.
а) 9,9∙10-11; б) 9,9∙10-6; в) 4,9∙10-6.
16. Определить концентрацию комплексного иона [Аu(СN)2 ]- в 0,05 М растворе К [Аu(СN)2 ], если a = 100 %.
а) 0,05; б) 0,025; в) 0,1.
17. Рассчитать концентрацию ионов Hg2+ в 0,02 М растворе K2 [HgBr4 ], если константа нестойкости комплексного иона равна 1∙10-21, и первичная диссоциация протекает полностью.
а) 1,5∙10-5; б) 1,9∙10-6; в) 4,5∙10-3 .
18. Чему равна степень гидролиза в 0,1 М растворе NаJO3, если К диссHJO3 = 0,16?
а) 7,9∙10-7; б) 1,9∙10-6; в) 4,5∙10-5.
19. Как изменяется рН и степень диссоциации (α) при добавлении ацетата натрия к водному раствору уксусной кислоты?
а) pH возрастает, а α уменьшается; б) pH и α одновременно уменьшаются; в) pH уменьшается, а α возрастает.
20. Какая из солей более растворима в кислом растворе, чем в чистой воде?
а) CdS; б) CuI; в) CaSO4.