XI. Электрохимические процессы
1. Гальваническим элементом называется устройство, в котором:
а) происходит преобразование химической энергии окислительно-восстановительного процесса в электрическую энергию; б) происходит преобразование тепловой энергии в механическую работу: в) происходит преобразование химической энергии окислительно-восстановительного процесса в тепловую энергию.
2. Каким типом проводимости должен обладать материал электрода в гальваническом элементе и при электролизере?
а) электронной проводимостью; б) дырочной проводимостью;
в) ионной проводимостью.
3. Какая схема будет соответствовать гальваническому элементу, в основе работы которого лежит токообразующая реакция
Zn + 2AgNO3 → Zn(NO3)2 + 2 Ag ?
а) (-) Zn│Zn(NO3)2║ AgNO3│ Ag (+);
б) (+)Zn│Zn(NO3)2║ AgNO3│ Ag (-);
в) (-)Zn│ AgNO3 ║ Zn(NO3)2│ Ag (+).
4. Чем является платина в гальваническом элементе
(-) Pt, H2 │HCl║ AgNO3│ Ag (+) ?
а) токопроводящим материалом; б) окислителем; в) восстановителем.
5. Уравнение Нернста для стандартных расчетов потенциала электрода имеет вид:
а)  ; б)
; б)  ;
;
в) 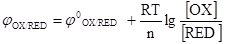 .
.
6. Электродвижущая сила гальванического элемента определяется:
а) максимальной разностью потенциалов катода и анода;
б) максимальной разностью потенциалов анода и катода;
в) минимальной разностью потенциалов электродов.
7. Изменение стандартного изобарно-изотермического потенциала (∆G0298) системы связано со стандартным значением электродвижущей силы (Е0) гальванической цепи соотношением:
а) ∆G0298= - nFE0; б) ∆G0298= - RTlgKp; в) ∆G0298=∆H - T∆S.
8. Какой процесс протекает на аноде в гальваническом элементе
Ni │Ni2+ (1М)║Н+ (1М)│Н2, Pt ?
а)  ; б)
; б)  ; в)
; в)  .
.
9. Какое значение имеет стандартная электродвижущая сила (Е0) в гальваническом элементе Ni │Ni2+ (1М)║Н+ (1М)│Н2, Pt (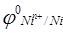 = - 0,24 В;
= - 0,24 В;  = 0,00 В) ?
= 0,00 В) ?
а) + 0,24 В; б) + 1,43 В; в) - 0,24 В.
10. Электролизом называется:
а) совокупность окислительно-восстановительных процессов на электродах при прохождении электрического тока от внешнего источника через раствор или расплав электролитов;
б) процессы окисления и восстановления в растворах электролитов;
в) преобразование энергии окислительно-восстановительных процессов в электрическую энергию.
11. Правило катодного восстановления при электролизе формулируется следующим образом…
а) в первую очередь на катоде восстанавливается система с максимальным значением потенциала;
б) в первую очередь на катоде восстанавливается система с минимальным значением потенциал;
в) в первую очередь на катоде окисляется система с наибольшим значением потенциала.
12. Правило анодного окисления при электролизе формулируется следующим образом…
а) в первую очередь на аноде окисляется система с наименьшим значением потенциала;
б) в первую очередь на аноде восстанавливается система с максимальным значением потенциал;
в) в первую очередь на аноде окисляется система с наибольшим значением потенциала.
13. При электролизе водного раствора сульфата натрия на катоде протекает процесс:
а)  (
(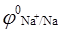 = - 2,71 В);
= - 2,71 В);
б) 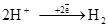 (
( = 0,00 В);
= 0,00 В);
в)  (
( - 0,41 В).
- 0,41 В).
14. При электролизе водного раствора соли KI на аноде протекает процесс:
а) 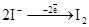 (
( = +0,54 В);
= +0,54 В);
б) 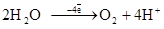 (
(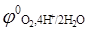 = 1,5 В);
= 1,5 В);
в)  (
(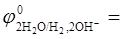 - 0,41 В).
- 0,41 В).
15. Какой процесс протекает на медном аноде при электролизе водного раствора серной кислоты:
а)  (
( = + 0,34 В);
= + 0,34 В);
б) 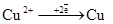 (
( = + 0,34 В);
= + 0,34 В);
в) 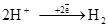 (
( = 0,00 В).
= 0,00 В).
16. Чем определяется ЭДС гальванического элемента
(-) Pt,H2│H+(1 М)║Cu2+(1 M)│Cu(+) в стандартных условиях?
а) разностью стандартных потенциалов катода и анода ;
б) суммой стандартных потенциалов катода и анода;
в) разностью потенциалов катода и анода.
17. Какова теоретическая последовательность осаждения металлов находящихся в растворе в виде ионов: Na+,K+,Al3+,Fe3+,Cd2+,Au3+, Ag+, Cu2+, если концентрация каждого иона равна 1 М, а потенциал катода 3 В.
а) Au3+, Ag+, Fe3+,Cu2+,Cd2+, остальные осаждаться не будут;
б) Cd2+,Cu2+,Fe3+,Ag+,Au3+, далее процесс электролиза воды;
в)Na+,K+,Al3+,Fe3+,Cd2+.
18. В каком случае выделяется больше серебра: при электролизе расплава или водного раствора AgNO3 (время электролиза и сила тока одинаковы):
а) одинаковое количество; б) в случае электролиза расплава;
в) в случае электролиза водного раствора.
19. Какой металл серебро, медь или висмут, находящийся в растворе своей соли в стандартных условиях, приобретает больший положительный заряд ( = + 0,34 В,
= + 0,34 В, 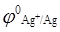 = + 0,8 В,
= + 0,8 В, 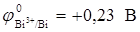 ):
):
а) серебро; б) медь; в) висмут.
20. Почему суммарные окислительно-восстановительные реакции электролиза протекают в направлении увеличения энергии Гиббса:
а) процесс является принудительным;
б) процесс является самопроизвольным;
в) система находится в состоянии равновесия .