Подготовка к выполнению работы и проведение анализа.
1. Повторить технику выполнения основных операций (с. 6–10);
2. Изучить основные аналитические реакции указанных ионов, используя растворы их солей;
3. Ознакомиться с рекомендациями к выполнению контрольных анализов (с. 10);
4. После этого получить у лаборантов контрольный (анализируемый) раствор и выполнить лабораторную работу в соответствии со схемой анализа (рис. 5) и приведенным ниже ходом выполнения. Результаты анализа представить в виде таблицы (образец – табл. 3).
Анализируемый раствор делят на три части: в одной проводят предварительные испытания, другую подвергают систематическому анализу, третью оставляют для проверки полученных результатов.
1. Предварительные испытания
(проводятся с отдельными порциями исследуемого раствора)
1.1. Проба на присутствие ионов Fe2+. Ион Fe2+ открывают первым, так как он легко окисляется кислородом воздуха до Fe3+. Небольшую порцию раствора подкисляют 2 н. НСl и приливают к ней 1-2 капли раствора K3[Fe(CN)6], стараясь не перемешивать содержимое пробирки. Выпадение синего осадка Fe3[Fe(CN)6]2 свидетельствует о наличии иона Fe2+. Следует иметь ввиду, что в присутствии катионов III группы осадок будет несколько менее синим.
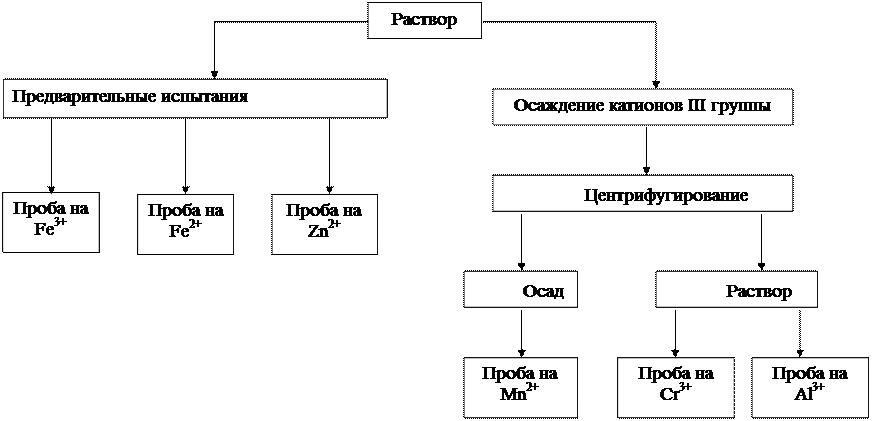
Рис. 5. Схема анализа смеси катионов III группы
1.2. Проба на присутствие ионов Fe3+. К отдельной порции исследуемого раствора, подкисленной 2 н. HCl, прибавляют несколько капель раствора K4[Fe(CN)6]. Выпадение синего осадка Fe4[Fe(CN)6]3 свидетельствует о наличии иона Fe3+. Присутствие катионов III группы несколько изменяет темно-синий цвет осадка.
1.3. Проба на присутствие ионов Zn2+.1–2 капли раствора помещают на полоску фильтровальной бумаги, смоченную раствором дитизона. Появление характерного малиново-красного окрашивания свидетельствует о присутствии ионов Zn2+.