Химические свойства аминов
1. Реакция ацилирования. Реакция протекает как АNu – ENu по карбонильной группе. Первичные и вторичные амины гладко реагируют с галогенангидридами и ангидридами кислот с образованием амидов кислот, третичные амины в эту реакцию не вступают:

При использовании галогенангидридов, выделяющийся галогеноводород связывается избытком амина или добавленым щелочным агентом:

Первичные и вторичные амины легко подвергаются ацилированию и при взаимодействии с алкил- и арилсульфохлоридами:

1.1 Ацилирование по методу Шотенна–Баумана. Реакцию осуществляют в присутствии концентрированного водного раствора NaOH, Na2CO3, NaHCO3, CH3COONa, MgO, CaO, BaO. Образование амида вместо возможного гидролиза ацилирующего агента в этих условиях объясняется тем, что ацилирование происходит в органической фазе (обычно в растворе углеводорода), а нейтрализация кислоты щелочью – в водной фазе:

2. Реакция алкилирования. Первичные, вторичные и третичные амины вступают в реакции с галогеналканами и спиртами. Эти реакции протекают как SN2:
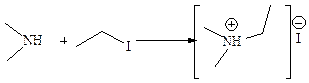
При алкилировании третичных аминов получают четвертичные аммониевые соединения:

2.1 Образование N-галогенаминов. В слабощелочной среде первичные и вторичные амины образуют с галогенами N-галогенамины:

2.2 Реакция взаимодействия ариламинов с арилгалогенидами. Первичные и вторичные ариламины сравнительно легко реагируют с активированными арилгалогенидами по механизму SN2.
Например, реакция анилина с 2,4-динитрохлорбензолом приводит к образованию динитродифениламина:

2.3 Перегруппировка Ортона (1901 г.). N-галогенариламины подвергаются перегруппировке с образованием п- и о-галогенариламинов:
