Факторы, определяющие реакционную способность органических соединений
I. Статические факторы (нереагирующее состояние):
· электронные факторы, обусловленные распределением электронной плотности в молекуле, предопределяющие появление реакционных центров в субстрате и направление атаки на него соответствующего реагента;
· стерический фактор, обусловливающий пространственные затруднения для атаки реагентом реакционного центра субстрата, окруженного объемными заместителями.
II. Динамические факторы (проявляются в процессе многостадийной реакции), определяющие предпочтительное протекание реакции в направлении образования наиболее стабильного интермедиата.
Кинетически контролируемая реакция – реакция, завершающаяся получением изомера, скорость образования которого наибольшая (в мягких условиях).
Термодинамически контролируемая реакция – преимущественное образование изомера с большей термодинамической устойчивостью (в более жестких условиях).
Характеристика компонентов реакций. Тип расщепления ковалентной связи.Каждая органическая реакция приводит к образованию соответствующих продуктов, т. е. характеризуется определенным направлением. С другой стороны, образование продуктов реакции протекает обычно через специфические для данной реакции промежуточные стадии. Из участвующих в реакции нескольких веществ одно часто рассматривается в качестве субстрата– объекта превращения, а другое реагента – атакующее вещество. При выборе реагента и субстрата руководствуются следующими правилами:
· в качестве субстрата выбирается соединение, один из атомов углерода которого является реакционным центром, тогда реагентом является вещество, атакующее С – атом субстрата;
· если в результате реакции образуется новая С–С связь, то в качестве реагента рассматривается соединение, у которого в реакции участвует более полярная связь.

Субстрат – органическое соединение более сложного строения, чем реагент, поставляющее для образования новой связи атом углерода.
Уходящая группа – замещаемая часть субстрата (Х).
Электрофуг – уходящая группа без пары электронов.
Нуклеофуг – уходящая группа с парой электронов.
Реакционный центр – атом или группа атомов, непосредственно участвующих в данной химической реакции.
Классификация реагентов проводится по наличию сродства к ядру (нуклеофилы), к электронам (электрофилы) или к атомам (радикалы). Первые два типа реагентов имеют четное число электронов, радикалы несут неспаренный электрон.
Свободные радикалы–атомы или частицы с неспаренным электроном.
Образуются при гомолитическом расщеплении ковалентной связи в результате:
· фотолиза;
· термолиза;
· окислительно-восстановительной реакции;
· под действием ультразвука.
Электрофильный реагент (электрофильная частица, электрофил – Еδ+ или ЕÅ) – положительно заряженный ион, электронейтральная молекула с электронодефицитным атомом или сильнополяризованная молекула, образующаяся в реакции комплексообразования с кислотами Льюиса. Электрофил – акцептор электронной пары. Чем выше электронодефи-цитность электрофила, тем выше его электрофильность.
Нуклеофильный реагент (нуклеофильная частица, нуклеофил – Nu) – отрицательно заряженный ион или электронейтральная молекула с атомом, имеющим свободную электронную пару, идущую на образование новой ковалентной связи. Нуклеофил – донор электронной пары. Нуклеофильность возрастает с уменьшением электроотрицательности атома (сравниваются элементы одного периода) и увеличением поляризуемости (сравниваются элементы одной группы). ЭД – заместители увеличивают, ЭА – заместители ослабляют нуклеофильные свойства. Анионы более нуклеофильны, чем нейтральные молекулы.
Таблица 11 – Примеры реагентов
| Свободные радикалы | Электрофилы | Нуклеофилы | |||
| строение | название | строение | название | строение | название |
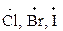
| галоген | Н+ | протон | 
| гидрид-ион |

| метил- | Н3О+ | катион гидроксония | 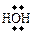
| вода |

| изопропил- | N+O2 | катион нитрония | 
| гидроксид-ион |
| Продолжение таблицы 11 | |||||

| бензоил- | N+O | катион нитрозония | 
| цианид-ион |

| бензоат- | [Ar-NºN]+ | катион диазония | 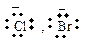
| хлорид, бромид-ион |

| аллил- | 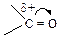
| карбонил | 
| метоксид-ион |
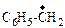
| бензил- | SO3 | триоксид серы | 
| метанол |
| – | – | R-C+=O | катион ацилия | 
| метантиол |
| – | – | 
| – | 
| метанамин |
| – | – | – | – | 
| диметило-вый эфир |
Амбидентный ион – термин, используемый для описания активных частиц, обладающих двумя различными взаимодействующими центрами, каждый из которых, в зависимости от условий, может участвовать в образовании различных химических связей.
Интермедиат – частица со временем жизни больше одного молекулярного колебания (10-13 сек). Интермедиат образуется из реагентов и ему соответствует локальный минимум потенциальной энергии. Превращения интермедиата приводят к продуктам реакции.
Карбанион – отрицательно заряженная частица (анион) имеющая четное число электронов, в которой отрицательный заряд (НЭП) полностью либо частично принадлежит одному или нескольким атомам углерода.
Карбен– термин, обозначающий частицы содержащие нейтральный атом углерода, имеющий два заместителя или два несвязывающих электрона, которые могут быть в синглетном или триплетном состоянии.
Карбин– термин, используемый для обозначения частицы Н·C: и ее производных (R·C:), в которых одновалентный атом углерода обладает тремя несвязанными электронами.
Карбкатион (карбениевый или карбониевый ион) – положительно заряженная частица, имеющая четное число электронов, в котором положительный заряд расположен на одном или нескольких атомах углерода. Часто этот термин применяют для карбкатионов, в которых атом углерода с избытком положительного заряда, обладает вакантной р-орбиталью.
Таблица 12 – Электронное строение интермедиатов.
| Название интер-та | Структ. | Гибридизация | Конфигурация | |
| Свободный радикал | 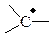
| sp2 | плоская | 
|
| Карбкатион | 
| sp2 | плоская | 
|
| Карбанион | 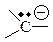
| sp2 (в сопряженной системе) | плоская | 
|
| sp3 (связан с sp3-гибридизованным атомом) | тетраэдр. | 
|