рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Реферат Курсовая Конспект
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ - раздел Образование, Основ...
ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Прежде всего, распределение электронов находится в зависимости от природы связанных атомов и взаимного влияния их друг на друга. Электронодонорные заместители (ЭД) –заместители, увеличиваю-щие электронную… Электроноакцепторные заместители (ЭА) – заместители, умень-шающие электронную плотность в системе.Графические способы описания делокализации электронов в сопряженных системах.
Концепция теории мезомерии.
Делокализацию электронов изображают стрелками.
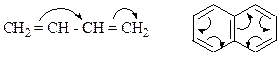
Концепция теории резонанса (Полинг, 1928 г.).
· Бензол может быть изображен пятью резонансными структурами:КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ И ПРОМЕЖУТОЧНЫХ ЧАСТИЦ
Химическая реакция – это следствие перераспределения электронов внешних оболочек атомов реагирующих веществ, в результате чего разрушаются одни и возникают новые химические связи.
Компоненты реакции:
· субстрат (с реакционным центром);
· атакующий реагент;
· интермедиат;
· катализатор (или ингибитор);
· конечные продукты реакции.
Химизм реакции – описание реакции с указанием только исходных веществ, конечных продуктов и условия проведения реакции.
Механизм реакции – это реальный путь, по которому протекает реакция. Описываемый в литературе механизм – гипотеза, предлагаемая для объяснения экспериментальных данных.
Движущей силой химических реакций является стремление к образованию новых, обладающих меньшей свободной энергией, и, следовательно, более стабильных систем.
Энергия активации – это избыточное количество энергии, которое необходимо придать исходной системе для преодоления энергетического барьера, чтобы прошла реакция.
Активированный комплекс – создается при сближении молекул, обладает наивысшей свободной энергией.
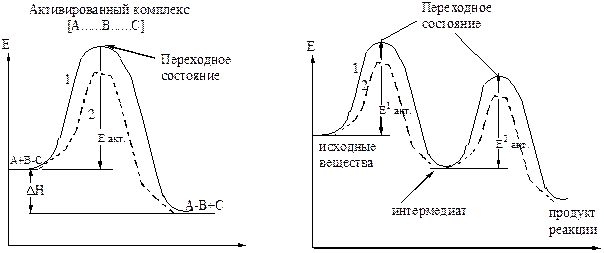
Ход одностадийной реакции Ход двухстадийной реакции
1 – некатализируемая реакция
2 – катализируемая реакция
Рисунок 20 – Энергетическая диаграмма химических реакций
Переходное состояние – участок энергетического профиля реакции, соответствующий энергии активированного комплекса.
Интермедиат – промежуточный продукт многостадийной реакции.
Лимитирующая стадия – определяющая скорость всего много-стадийного процесса, стадия образования интермедиата.
Катализатор – понижает величину энергии активации, увеличивает скорость химической реакции.
Реакционная способность – способность вещества вступать в ту или иную химическую реакцию и реагировать с большей или меньшей скоростью.
Органическую химию отличает чрезвычайное разнообразие превращений. Для ориентирования разработана классификация органических реакций по различным признакам. Все органические реакции подразделяют по механизму, направлению, молекулярности, агрегатному состоянию, принадлежности реагента или продуктов к различным классам соединений.
По характеру реагирующих частиц и типу разрыва ковалентной связи реакции могут быть:
· гомолитическими;
· гетеролитическими.
Гомолитические (радикальные реакции) сопровождаются гомолитиче-ским разрывом ковалентной связи. Реагентами в таких реакциях обычно являются радикалы либо молекулы, легко разрушающиеся до радикалов в условиях реакции, или атомы. В условия осуществления гомолитических реакций включают газовую фазу или неполярный растворитель, высокие температуры, воздействие светом или высокой энергией.
Гетеролитические (ионные, полярные) реакции сопровождаются гетеролитическим распадом связи. В отличие от гомолитических такие реакции протекают в полярной среде при умеренных температурах и нередко требуют присутствия катализатора. Гетеролитические реакции по характеру реагента подразделяют на два типа:
· нуклеофильные реакции, в которых образование новой связи осуществляется за счет электронов реагента (нуклеофила);
· электрофильные реакции, в которых образование новой связи осуществляется за счет электронов субстрата, реагент – электрофил.
Такое деление реакций справедливо для элементарных стадий, т. к. во многих реакциях происходит одновременно разрыв и образование новых связей за счет перемещения электронов с образованием переходного комплекса.
По направлению и конечному результату (по суммарному изменению, происходящему в исходных молекулах) различают следующие реакции:
· реакции, протекающие с сохранением углеродного скелета;
· реакции, протекающие без сохранения углеродного скелета.
Реакции, протекающие с сохранением углеродного скелета:
· реакции присоединения – А (от англ. addition);
· реакции отщепления – E (от англ. elimination);
· реакции замещения – S (от англ. substitution);
· реакции перегруппировки (изомеризации);
· конденсации;
· поликонденсации;
· полимеризации;
· перциклизации.
Реакции, протекающие без сохранения углеродного скелета:
· удлинения цепи;
· укорачивания цепи;
· циклизации;
· раскрытия цикла;
· сжатия и расширения цикла.
По предпочтительному образованию одного из нескольких возможных изомеров:
· региоселективные и региоспецифичные;
· стереоселективные и стереоспецифичные;
· хемоселективные;
· кислотно-основные взаимодействия;
· согласованные реакции.
Региоселективные реакции– реакции, предпочтительно протекающие по одному из нескольких реакционных центров с образованием смеси структурных изомеров с преобладанием одного из них.
Региоспецифичные реакции – реакции, протекающие с образованием только одного из изомеров.
Стереоселективные реакции – реакции, протекающие с предпочтительным образованием одного из стереоизомеров.
Стереоспецифические реакции– реакции, в результате которых из данного стереоизомерного соединения получается только один стереоизомер.
Хемоселективные реакции– реакции, предпочтительно протекающие по одной из родственных групп.
Согласованные (синхронные) реакции – реакции, в которых разрыв старых связей и образование новых связей происходит одновременно без участия радикалов или ионных частиц.
Молекулярность органической реакции определяют по числу молекул, в которых происходит реальное изменение ковалентных связей на лимитирующей стадии реакции. Различают следующие виды реакций:
мономолекулярные – на лимитирующей стадии участвует одна молекула; бимолекулярные – две молекулы и т. д.
По агрегатному состоянию реагирующих веществ реакции подразделяют на гомогенные, т. е. протекающие в одной фазе и гетерогенные, идущие на границе раздела фаз.
Часто органические реакции классифицируют по принадлежности реагентов или продуктов реакции к различным классам соединений. Например – гидрирование, гидратация, галогенирование, алкоголиз, эфиролиз и т. д.
Особенности ионных и радикальных реакций.
Ионные реакции
· проходят в полярных растворителях;
· ускоряются под действием кислотных или основных катализаторов;
· скорость реакции не изменяется в присутствии акцепторов свободных радикалов;
· в кинетическом отношении являются реакциями первого или второго порядка.
Радикальные реакции
· ускоряются под действием света, нагревания или свободными радикалами, образующимися при разложении других веществ; · замедляются веществами, легко реагирующими со свободными радикалами; · в кинетическом отношении являются цепными.Факторы, определяющие реакционную способность органических соединений
· электронные факторы, обусловленные распределением электронной плотности в молекуле, предопределяющие появление реакционных центров в субстрате и… · стерический фактор, обусловливающий пространственные затруднения для атаки… II. Динамические факторы (проявляются в процессе многостадийной реакции), определяющие предпочтительное протекание…Стабилизация интермедиатов.
· Свободные радикалы.
Стерический фактор стабилизации.
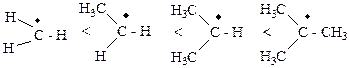
Резонансная стабилизация.
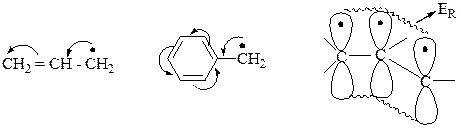
· Карбкатионы, карбанионы.
Индуктивная стабилизация (газовая фаза)
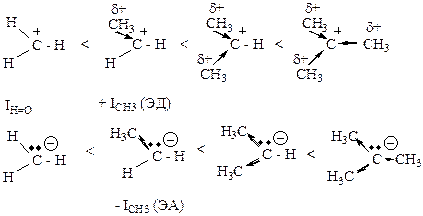
Резонансная стабилизация.
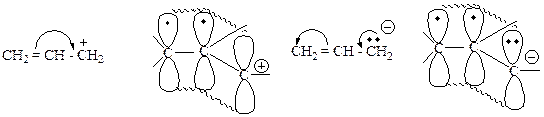
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Классификация (лат. classis – разряд, facere – делать) – распределение органических соединений по рядам, группам, классам в зависимости от их классификационных признаков.
Существующая классификация органических соединений основана, прежде всего, на структуре углеводородного скелета и характере функциональных групп. Классификацию органических соединений по основным признакам можно представить в виде схемы (рис.19).
Первым классификационным признакомявляется структура углеродного скелета углеводородного фрагмента молекулы. По этому признаку органические соединения делятся на следующие ряды:
· ряд ациклических соединений;
· ряд карбоциклических соединений;
· ряд гетероциклических соединений.
Ациклические соединения [гр. a…, an – частица отрицания] – органи-ческие соединения, в молекулах которых отсутствуют циклы и все атомы углерода соединены между собой в прямые или разветвленные открытые цепи. Иногда их называют алифатическими (гр. alefair – жир), поскольку к этому классу относят жиры и жирные кислоты а также алициклические соединения – циклоалканы, циклоолефины, циклодиены, циклодиины.
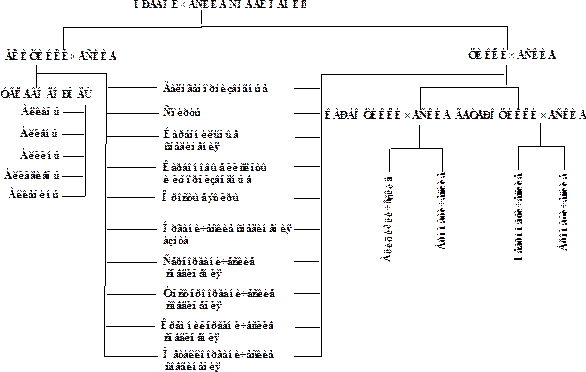
Рисунок 19 – Основные классы органических соединений
Структура углеводородного скелета может быть линейной и замкнутой в цикл. Прямая цепь углеродных атомов – цепь последовательно соединенных атомов. Разветвленная цепь углеродных атомов – цепь непоследовательно соединенных атомов: от средних атомов прямой цепи отходят прямые цепи.
Различают две основные группы ациклических соединений:
· насыщенные (предельные), у которых в углеводородном фрагменте все атомы углерода связаны между собой только простыми связями (1);
· ненасыщенные(непредельные), у которых между атомами углерода в углеводородном фрагменте, кроме простых (одинарных) связей, имеются также двойные или тройные связи.
Циклическиесоединения подразделяются на карбоциклические, циклы которых состоят только из атомов углерода, и гетероциклические, в состав циклов которых, кроме атомов углерода входят атомы других элементов – гетероатомы (O, N, S и др.).
Карбоциклические соединения – органические соединения, характери-зующиеся наличием колец (циклов) из атомов углерода. Карбоциклические соединения подразделяются на:
· алициклические соединения;
· ароматические соединения.
Гетероциклические соединения – органические соединения, в цикле которых, кроме атомов углерода, содержатся гетероатомы, способные образовать не менее двух ковалентных связей (N, O, S).
Вторым классификационным признакомявляется электронное строение молекулы. По этому признаку органические соединения подразделяются на:
· алифатические соединения
· ароматические соединения
Третьим классификационным признаком является характер функциональной группы, определяющей функциональный класс.
Функциональный класс– группа соединений, объединяемых общей функциональной группой.
При замене в углеводороде (R–H) атомов водорода на другие атомы или функциональные группы (Х) образуются новые классы органических соединений (R–Х), характер которых определяют функциональные группы.
Функциональная группа – гетероатом или группа атомов неуглеводо-родного характера, определяющих принадлежность к определенному функциональному классу и обуславливающая важнейшие свойства этого класса (табл. 6).
Таблица 6 – Функциональные производные углеводородов
| Функциональная группа | Название группы | Название класса | Общая формула |
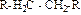
| функциональной группы нет | алканы | СnH2n+2 |
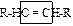
| двойная связь (усл. функция) | алкены | СnH2n |

| тройная связь (усл. функция) | алкины | СnH2n-2 |
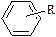
| функциональной группы нет | арены | СnH2n-6 |
| Hal– (F–,Cl–,Br–,I–) | галогено – | галогениды | R–Hal |
| OH– | гидрокси – | спирты | R–OH |
| OR– | алкокси – | простые эфиры | R–OR |
| –O– | эпокси – | эпокси | R–O–R |
| карбонильная | альдегиды, кетоны | 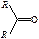
|
| –COOH | карбоксильная | карбоновые кислоты | R–COOH |
| Продолжение таблицы 6 | |||
| –COOR | сложноэфирная | сложные эфиры | R–COOR |
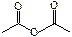
| ангидридная | ангидриды кислот | 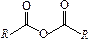
|
| –O–O– | пероксидная | пероксиды | R–O–O–R |
| карбонилгалогенидная | галогенангидриды кислот | 
|
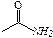
| карбамидная | амиды кислот | 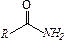
|
| –NH2 | амино – | первичные амины | R–NH2 |
| –NH– | имино – | вторичные амины | R–NH–R |
| >N– | аза – | третичные амины | R3N |
| –NO2 | нитро – | нитросоединения | R–NO2 |
| –C≡N | карбонитрильная (циано –) | нитрилы (цианиды) | R–C≡N |
| –NH–NH2 | гидразино – | гидразины | R–NH– NH2 |
| –N=N– | азо – | азосоединения | R–N=N–R |
| –N+≡N | диазо – | диазосоединения | R–N+≡N |
| –SH | тиоспиртовая (сульфгидридная) | тиолы (меркаптаны) | R–SH |
| –SR | тиоэфирная (алкилтио –) | тиоэфиры (сульфиды) | R–SR |
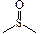
| сульфоксидная | сульфоксиды | 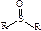
|
| –SO3H | сульфо – | сульфокислоты | R–SO3H |
| Э (S, N, O …) | элементо – | элементорганические соединения | R–Э |
| Me (Na, Li …) | металло – | металлорганические соединения | R– Me |
Монофункциональные соединения – соединения с одной функциональной группой, например:
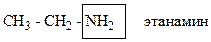
Кроме монофункциональных углеводородов, имеются самые разнообразные полифункциональные производные с несколькими одинаковыми или разными функциональными группами.
Гомофункциональные соединения– соединения с несколькими одинаковыми функциональными группами, например:
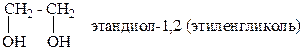
Гетерофункциональные соединения – соединения с несколькими разными функциональными группами, например:
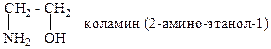
Гомологический ряд [гр. homologia – согласие] – группа родственных органических соединений с одинаковыми функциональными группами и однотипной структурой, отличающихся между собой на одну или несколько метиленовых групп (–СН2–) в составе углеводородного фрагмента молекулы и обладающих сходными химическими свойствами.
Гомологическая разность – (СН2)n, где n = 1, 2, 3 и т. д.
Изологический ряд – группа углеводородов и их производных с одинаковым числом углеродных атомов в радикале и тождественными функциональными группами, но с различной степенью ненасыщенности, т. е. с возрастающим в каждом изологическом ряду количеством кратных связей в радикале.
Изологическая разность – (2Н)n, где n = 1, 2
Генетический ряд – группа органических соединений с одинаковым углеводородным радикалом в молекуле, но с различными функциональными группами.
Классификация органических соединений позволяет не только систематизировать многочисленные органические соединения, но и является фундаментом для создания правил построения названий любого органического соединения исходя из его классической структурной формулы.
Номенклатура органических соединений. Номенклатура (лат. nomencklatura – роспись имен) это система правил построения названия соединения. Огромное число органических соединений, сложность и многообразие их строения обуславливают сложность их номенклатуры. По мере развития органической химии было предложено несколько различных систем номенклатуры.
Исторически первой возникла тривиальная номенклатура (лат. trivialis – обыкновенный). Органические соединения получали случайные названия, в которых отражались либо природные источники получения (яблочная кислота, муравьиная кислота, винный спирт), либо заметные свойства (гремучая кислота) и т. д.
С ростом числа органических соединений появилась необходимость в разработке четких и однозначных правил их названия.
Рациональная номенклатура связывает название вещества с его строением и классом. Соединение рассматривается как продукт усложнения простейшего представителя данного класса. Рациональное название очень наглядно в случае простых соединений, однако, по мере усложнения строения возможности рациональной номенклатуры, исчерпываются.
Для того чтобы назвать соединение по рациональной номенклатуре необходимо:
· определить класс называемого соединения;
· выбрать в соединении основу (табл. 7);
· назвать окружающие заместители;
· составить название, начиная с названий простых заместителей к более сложным, заканчивая названием основы.
Таблица 7 – Основы рациональных названий и окончаний в систематической номенклатуре некоторых классов органических соединений
| Класс называемого соединения | Основа рационального названия | Окончание в систематической номенклатуре |
| алканы |  метан
метан
| -ан |
| алкены | 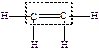 этилен
этилен
| -ен |
| алкины | 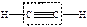 ацетилен
ацетилен
| -ин |
| спирты | 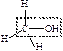 карбинол
карбинол
| -ан + ол |
| альдегиды | 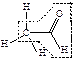 уксусный альдегид
уксусный альдегид
| -ан + аль |
| кетоны | 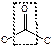 кетон
кетон
| -ан + он |
| карбоновые кислоты | 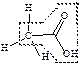 уксусная кислота
уксусная кислота
| -ан +овая кислота |
В качестве заместителей могут выступать как функциональные группы, так и углеводородные остатки. Углеводородный радикал – остаток молекулы углеводорода, из которого формально удалили один или несколько атомов водорода, оставив свободными соответственно одну или несколько валентностей.
Название углеводородных радикалов состоит из:
· префикса, указывающего на порядок соединения атомов углерода в радикале;
· корня (основы), отражающего число углеродных атомов;
· суффикса: -ил – для одновалентных радикалов;
-илен – для двухвалентных вицинальных радикалов;
-илиден – для двухвалентных геминальных радикалов;
-илидин – для трехвалентных геминальных радикалов.
Углеводородные остатки могут быть первичными, вторичными и третичными, в зависимости от типа атома углерода, имеющего свободную валентность.
Двухвалентные углеводородные остатки образуются при отнятии от углеводорода двух атомов водорода, при этом свободные валентности могут располагаться как у одного атома углерода так и у разных (табл.8 ).
В рациональной номенклатуре допускается несколько равноправных названий для одного соединения в зависимости от выбранной основы.
Таблица 8 – Углеводороды и углеводородные остатки
| Углеводород и его название | Углеводородные остатки | ||
| формула | Тривиальные названия | Характер радикала | |
| СnH2n+2 алкан | СnH2n+1– | алкил | |
| СH4 метан | СH3– | метил | |
| СH3–СH3 этан | СH3–СH2– | этил | первичный |
| СH3–СH2–СH3 пропан | СH3–СH2–СH2– | пропил | первичный |
| (СH3)2СН– | изопропил | вторичный | |
| СH3–(СH2)2–СH3 бутан | СH3–СH2–СH2–СH2– | н-бутил | первичный |
| СH3–СH(СH3)–СH3 изобутан | СH3–СН(СH3)–СH2– | изобутил | первичный |
| СH3–СН2–(СH3)СH– | вторичный бутил | вторичный | |
| (СH3)3С– | третичный бутил | третичный | |
| СH3–(СH2)3–СH3 | СH3–(СH2)3–СH2– | н-пентил (амил) | первичный |
| изопентан | СH3–СН(СH3)–СH2–СH2– | изопентил | первичный |
| СH3–СH2–СН(СH3)–СH2– | втор. пентил | первичный | |
| СH3–СH2–СH2–(СH3)СН– | втор. пентил | вторичный | |
| неопентан | (СH3)3С–СH2– | неопентил | первичный |
| СnH2n алкен | СnH2n -1– | алкенил | |
| Продолжение таблицы 8 | |||
| СH2=СH2 этен | СH2=СH– | этенил | первичный |
| СH3–СH=СH2 пропен | СH2=СH–СH2– | пропенил–2 (аллил) | первичный |
| СH3–СH=СH– | пропенил | первичный | |
| СnH2n -2 алкин | СnH2n -3– | алкинил | |
| СH≡СH этин | СH≡С– | этинил | первичный |
| СH3–С≡СH пропин | СH3–С≡С– | пропинил | первичный |
| СH≡С–СH2– | пропинил–2 (пропаргил) | первичный | |
| СnH2n -6 арен | СnH2n -7 | арил | – |
| С6H6 | С6H5– | фенил | – |
| С6H5–СH3 толуол | С6H5–СH2– | бензил | первичный |
| СH3–С6H4– | толуидил (о–, п–, м–) | – | |
| СH4 метан | –СH2– | метилен | – |
| СH2=СH2 этен | СH2=С< | винилиден | – |
Префикс – приставка (лат. praefixum от prae – впереди + fixus – прикрепленный). Префиксы н-, втор.-, трет.- выделяются курсивом, от основания отделяются дефисом.
Префиксы, напечатанные курсивом, не учитываются при расстановке заместителей в названии в алфавитном порядке.
Курсивом выделяются:
· префиксы: н-, втор.-, трет.-, цис-, транс-, D-, L-, R-, S-, E-, Z-, син-, анти-, эндо-, экзо-, гош-;
· буквенные локанты: α-, β-, γ- и т. д. орто (о-), мета (м-), пара, (п-), N.
Буквы латинского алфавита предшествуют буквам греческого алфавита.
Дефис (лат. divisio – разделение) – короткая соединительная черточка между двумя словами. Применяется для отделения от названия основы цифровых и буквенных локантов, префиксов, выделенных курсивом.
Умножающие префиксы:
· ди-, три-, тетра-, пента- и т. д. применяются для обозначения числа одинаковых незамещенных радикалов, например триэтиламин;
· бис-, трис-, тетракис-, пентакис- и т.д. применяются для обозначения числа идентичных одинаково замещенных радикалов, например бис-(2-хлорэтил)амин, трис-(2-хлорэтил);
· би-, тер-, квартер- употребляются для указания числа идентичных колец, соединенных друг с другом связью.
Вицинальный радикал (лат. vicinus – соседний): свободные валентности находятся у соседних атомов углерода.
Геминальный радикал (лат. geminus – близнецы): свободные валент-ности находятся у одного и того же атома углерода.
Примечание. Геминальный двухвалентный радикал:
· –СН2– обозначается суффиксом -илен (метилен);
· –СН2–СН2–СН2– называется триметилен;
· –СН2(СН3)СН– обозначается суффиксом -илен (пропилен).
Систематическая номенклатура. В 1892 г. появилась Женевская номенклатура. Позже ее положения были переработаны в Льежскую номенклатуру (1930 г.). В 1957 г. были приняты правила IUPAC(International Union of Pure and Applied Chemistry).
В рамках этой номенклатуры соединения рассматриваются как продукты усложнения нормальных предельных углеводородов либо замещенных циклов, получаемых путем замещения атомов водорода какими-либо структурными фрагментами. Характер заместителя указывается приставкой (префиксом) или окончанием. Для уточнения положения производится нумерация атомов основы (локантов).
Способы построения названия в номенклатуре IUPAC (на примере ациклического соединения):
· выбрать основу, в качестве которой избирается самая длинная цепь углеродных атомов, в которой содержатся функциональные группы и кратные связи;
· пронумеровать основу, начиная с наиболее замещенного конца. Начало нумерации определяет старшая функциональная группа, затем кратная связь и углеводородный заместитель. По уменьшению старшинства некоторые функциональные группы располагаются следующим образом:
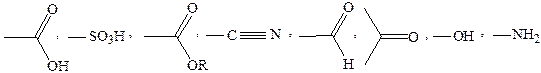
· составить название, включающее название заместителей в алфавитном порядке, название главной цепи, окончание, характерное для кратной связи и старшей функциональной группы. Положение заместителей и функциональной группы указывается цифрами, их количество – греческими числительными.
Примеры построения названий по систематической номенклатуре
I.
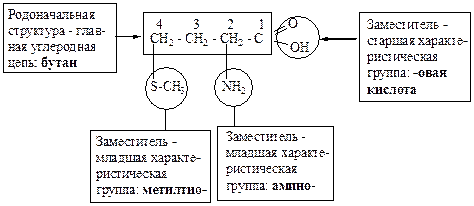
Название: 2-амино-4-метилтиобутановая кислота.
II.
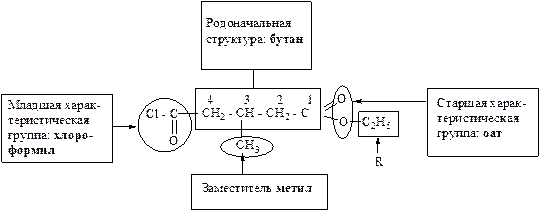
Название: 3-метил-4-хлорформил-этил-бутаноат.
III.
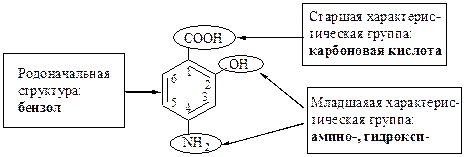
Название: 4-амино-2-гидроксибензолкарбоновая кислота.
КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Кислотность и основность – важнейшие понятия, определяющие многие фундаментальные физико-химические свойства и биологическую активность органических соединений.
Основные теории кислот и оснований:
· Ионная теория (С. Аррениус, 1887 г.)
· Протолитическая теория Бренстеда-Лоури (1923 г.).
· Апротонная теория Льюиса.
· Концепция жестких и мягких кислот и оснований (ЖМКО) Р. Пирсона (1963 г.).
Кислотные и основные функции веществ
Согласно ионной теории кислоты – это электролиты, отщепляющие в водном растворе ионы Н +, а основания – электролиты, отщепляющие в водном растворе ионы ОН –. В результате ассоциации этих ионов между кислотой и основанием происходит реакция нейтрализации с образованием воды и соответствующей соли.
Кислотность и основность по Бренстеду-Лоури.
Основания – вещества, способные присоединять протон (акцепторы протона). Таблица 13 – Типы органических кислот по Бренстеду. Тип кислоты Нейтральные молекулы …Примеры.
Электроотрицательность (учитывается для атомов одного периода).
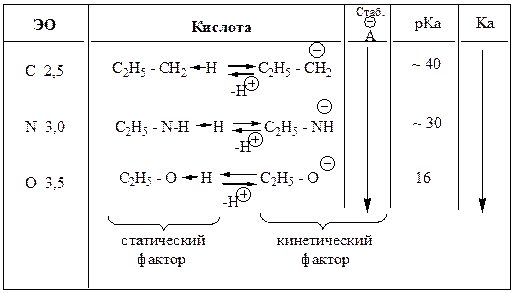
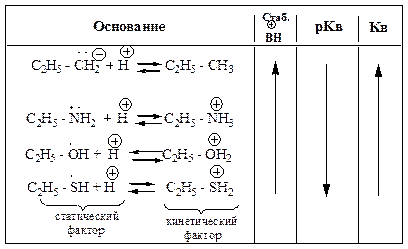
Поляризуемость (учитывается для элементов одной группы).
Электронные эффекты заместителей.
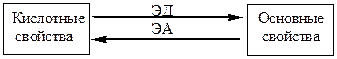
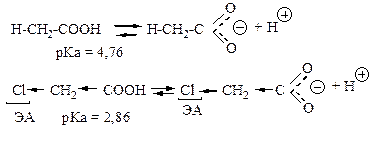
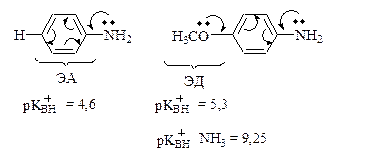
Стерический фактор.
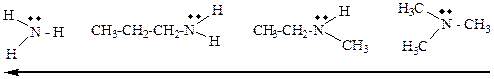
основность
Орто-эффект.
Салицилат-анион Ка = 11· 10-5 Ка = 3,3 · 10-5 Ка = 6,6 · 10-5Кислотность спиртов.
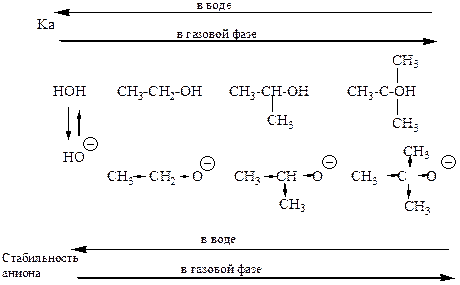
Сольватация аминов.
Таблица 16 – Основность алифатических аминов. Амины +I CH3 (суммарный) Стерический эффект Эффект сольватации … В молекулах, имеющих близкие по размерам углеводородные радикалы,…Кислоты и основания Льюиса.
Основания Льюиса – доноры пары электронов. В кислотно-основной реакции кислота Льюиса представляет валентную орбиталь для…Жесткие и мягкие кислоты и основания по Пирсону (ЖМКО).
Мягкие кислоты – кислоты Льюиса, в которых акцепторные атомы большого размера с малым положительным зарядом, небольшой электроотрицательностью,… Жесткие основания – донорные частицы, обладающие высокой… Мягкие основания – донорные частицы с низкой электро-отрицательностью, высокой поляризуемостю, легко окисляющиеся.…Схематическое изображение взаимодействия жестких и мягких кислот и оснований.
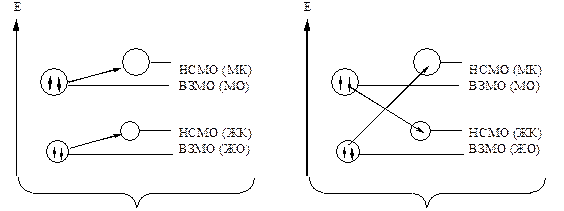
Взаимодействие эффективно Взаимодействие не эффективно
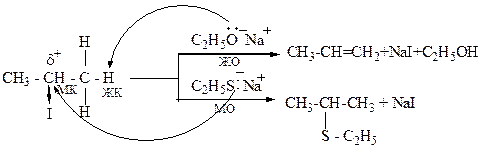
Таблица 18 – Жесткие и мягкие кислоты и основания
| Основания | Кислоты | ||
| жесткие | мягкие | жесткие | мягкие |
H2O, HO-
ROH, RO-
 Cl-, F-
Cl-, F-
| RSR, RSH, RS-
H-, I-
R2C = CR2
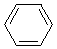
| H+, Na+, K+ Mg2+, Ca2+, Mn2+ Al3+, AlCl3 R – C+ = O | Cu2+
I2
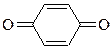
|
| Промежуточные | |||
Br–, C6H5NH2,
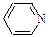
| Cu2+, Fe2+, R3C+, C6H5+ |
Примечание: ВЗМО – высшая занятая молекулярная орбиталь.
НСМО – низшая свободная молекулярная орбиталь.
УГЛЕВОДОРОДЫ
АЛКАНЫ
Алканы – простейший класс органических соединений, не содержащих какой-либо функциональной группы. Алканы отвечают общей формуле – СnН2n+2. Для неразветвленных (нормальных) алканов с длиной цепочкой она может быть представлена следующим образом:
Н–(СН2)n–H
Номенклатура алканов. Простейшим соединением ряда алканов является метан СН4. Для названия алканов используют следующие номенклатуры:
· тривиальную;
· рациональную;
· систематическую.
Тривиальная. Первые четыре представителя с неразветвленной цепью имеют тривиальные названия:
· метан (корень «мет» обозначает группировку, содержащую один атом углерода, первым таким веществом в истории химии был метиловый спирт (древесный спирт, метанол) от гр. methy –вино, hile – лес);
· этан, содержащий группировку из двух атомов углерода (от гр. aither – небесная субстанция, улетающая к небесам) дух эфира, летучий газ);
· пропан – трехатомная группировка (от гр. protos – первый, pion – жир);
· бутан – черырехатомная группировка (от лат. butyron – масло).
Названия последующих членов ряда, начиная с пентана, образуются от греческих числительных, указывая число атомов углерода в цепи, и окончания "ан".
Рациональная. В основу названия положен простейший представитель – метан, остальные предельные углеводороды рассматривают как его производные. Перед названием прототипа перечисляют радикалы (табл. 8) в порядке увеличения числа углеродных атомов.
Систематическая (заместительная, международная, ИЮПАК). По заместительной номенклатуре предельные углеводороды рассматриваются как производные линейных углеводородов, у которых один или несколько атомов водорода замещены на алкильные радикалы.
Изомерия. Для алканов характерны следующие виды изомерии:
Структурная:
· скелетная.
Пространственная:
· конформационная;
· оптическая.
Способы получения.
1. Получение из нефти. Алканы С1 – С40 является основной составляющей нефти, где наряду с предельными углеводородами содержатся циклоалканы,… · газообразные алканы состава С1 – С4 содержатся в газовой фракции нефти; · жидкие алканы от С5 до С10 входят в состав бензиновых фракций, выделены в чистом виде все 5 изомеров гексана, 7 из…Химические свойства.
1. Реакции замещения атомов водорода при взаимодействии с активными радикалами. 1.1 Галогенирование. Алканы вступают в реакцию со всеми галогенами, скорость…– Конец работы –
Используемые теги: основные, понятия, реакционной, Способности, органических, молекул0.085
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОСНОВНЫЕ ПОНЯТИЯ О РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов