Термодинамические условия равновесия в двухкомпонентных сплавах
Различают следующие виды диаграмм состояния двухкомпонентных сплавов:
1.Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)
2.Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси)
3.Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
4.Диаграмма состояния сплавов, компоненты которых образуют химические соединения.
5.Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость)
6. Диаграмма состояния сплавов, когда один из элементов обладает полиморфизмом (аллотропией), то есть способностью изменять тип своей кристаллической решётки, в зависимости от температуры и давления.
7. Другие виды диаграмм.
Приведем пример построения и анализа диаграммы состояния на примере диаграммы состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью).
Диаграмма состояния и кривые охлаждения сплавов системы представлены на рис. 5.1.
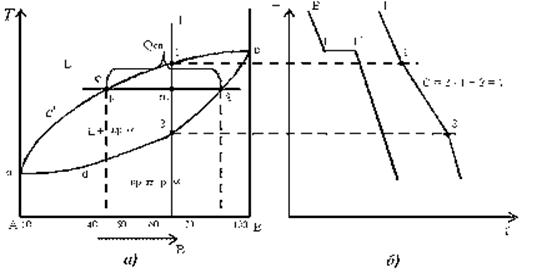
Рис. 5.1. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (а); кривые охлаждения типичных сплавов (б)
Сначала получают термические кривые. Полученные точки переносят на диаграмму, соединив точки начала кристаллизации сплавов и точки конца кристаллизации, получают диаграмму состояния.
Проведем анализ полученной диаграммы.
1. Количество компонентов: К = 2 (компоненты А и В).
2. Число фаз: f = 2 (жидкая фаза L, кристаллы твердого раствора 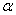 )
)
3. Основные линии диаграммы:
-acb – линия ликвидус, выше этой линии сплавы находятся в жидком состоянии;
-adb – линия солидус, ниже этой линии сплавы находятся в твердом состоянии.
4. Характерные сплавы системы:
Чистые компоненты А и В кристаллизуются при постоянной температуре, кривая охлаждения компонента В представлена на рис. 5.6 б.
Остальные сплавы кристаллизуются аналогично сплаву I, кривая охлаждения которого представлена на рис. 5.6 б.
Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора 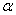 . На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов твердого раствора α) число степеней свободы будет равно единице
. На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов твердого раствора α) число степеней свободы будет равно единице
(C=2 –2+.1=1). При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора α.
5. Количественный структурно-фазовый анализ сплава.
Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов).
а). Определение состава фаз в точке m:
Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус.
Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации.
Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации.
Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса. С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В.
б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m):
Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды. Рассмотрим проведенную через точку m коноду и ее отрезки.
Количество всего сплава (Qсп) определяется отрезком pq.
Отрезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы.
Qmв = pm/pq * 100%
Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы.
Qж = mq/pq* 100%
Диаграммы сплавов с ограниченной растворимостью компонентов более сложны и входят, например, в диаграммы таких промышленных сплавов как железо – углерод, алюминий – медь и др. Выше линии ECF (рис.3.2.) – однородный жидкий раствор. Линия EDCKF – линия конца затвердевания. Линия DCK – линия эвтектического положения, а точка С – эвтектическая точка (сплав двух компонентов, который плавится при минимальной температуре, называется эвтектическим или эвтектикой). При достижении t°С, соответствующей линии DCK происходит эвтектическая реакция – из жидкости выделяется смесь кристаллов обоих твёрдых растворов α и β.
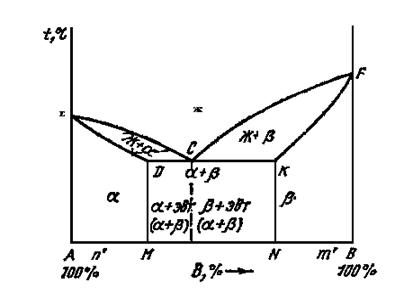
Рис. 5.2. Диаграмма состояния сплавов с ограниченной взаимной растворимостью компонентов в твердом состоянии
Существуют диаграммы состояния сплавов, учитывающие превращения в твёрдом состоянии (рис. 5.3.). FK – линия эвтектики. Левее FM эвтектики не может быть. Это линия переменной растворимости компонента В в А. Кристаллы компонентов выделяются из эвтектики называются вторичными. Аналогично и по линии KN.
Связь между свойствами сплавов и типом диаграммы состояния
Так как вид диаграммы, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, то между ними должна существовать определенная связь. Эта зависимость установлена Курнаковым.
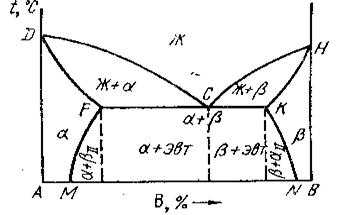
Рис. 5.3. Диаграмма состояния сплавов с переменной растворимостью компонентов в твердом состоянии
1. При образовании механических смесей свойства изменяются по линейному закону. Значения характеристик свойств сплава находятся в интервале между характеристиками чистых компонентов.
2. При образовании твердых растворов с неограниченной растворимостью свойства сплавов изменяются по криволинейной зависимости, причем некоторые свойства, например, электросопротивление, могут значительно отличаться от свойств компонентов.
3. При образовании твердых растворов с ограниченной растворимостью свойства в интервале концентраций, отвечающих однофазным твердым растворам, изменяются по криволинейному закону, а в двухфазной области – по линейному закону. Причем крайние точки на прямой являются свойствами чистых фаз, предельно насыщенных твердых растворов, образующих данную смесь.
4. При образовании химических соединений концентрация химического соединения отвечает максимуму на кривой. Эта точка перелома, соответствующая химическому соединению, называется сингулярной точкой.