Характерные свойства металлов
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств: «металлический блеск» (хорошая отражательная способность); пластичность; высокая теплопроводность; высокая электропроводность.
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
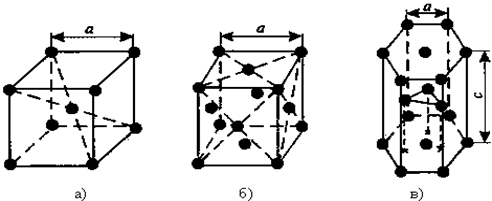
Рис. 1.1. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б – гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических решеток являются:
1.Объемно-центрированная кубическая (ОЦК) (рис.1.1 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
2.Гранецентрированная кубическая (ГЦК) (рис. 1.1 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au, Feβ)
3.Гексагональная, в основании которой лежит шестиугольник:
- простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
- плотноупакованная (ГПУ) (рис.1.1 в) – имеется 3 дополнительных атома в средней плоскости (цинк).