Термодинамические основы, механизм и кинетика кристаллизации металлов
Состояние вещества связано с условиями, в которых оно находится. Одно и тоже вещество в различных интервалах температур и давлений может находиться в состояниях, отличающихся друг от друга по своим свойствам. Выделяют четыре основных агрегатных состояния: твердое, жидкое и газообразное, плазма (сильно ионизированный газ с высокой относительной концентрацией заряженных частиц, который в целом электрически нейтрален). Плазма является самым распространённым состоянием вещества во Вселенной, так как из неё состоит большинство звезд.
Существуют другие агрегатные состояния, например, нейтронная жидкость (из неё состоят нейтронные звезды), конденсат Бозе-Энштейна (существует при сверхнизких температурах, когда скорости молекул снижаются настолько, что не возможно точно определить их местоположение). Однако далее такие состояния вещества нами изучаться не будут.
Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний (рис. 2.1). В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
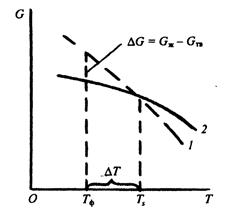
Рис. 2.1. Изменение свободной энергии в зависимости от температуры:
1 – жидкое состояние; 2- кристаллическое состояние
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура Тs. – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется фактической температурой кристаллизации Тф.
Разность между теоретической и фактической температурой кристаллизации называется степенью переохлаждения: ΔТ=ТS –Тф. Чем больше степень переохлаждения, тем интенсивнее будет идти кристаллизация.
При переходе аморфного тела из жидкого состояния в твердое никаких качественных изменений в строении металла не происходит. В твердом состоянии атомы в аморфном теле расположены так же хаотично как и в жидком, но только более компактно и вследствие этого имеют более ограниченную свободу перемещения. В отличие от кристаллических тел аморфные тела не обладают дальним порядком в расположении атомов и молекул.
При нагреве всех кристаллических тел, в том числе и металлов, всегда наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же четкая граница существует при переходе из жидкого состояния в твердое.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура (рис. 2.2).
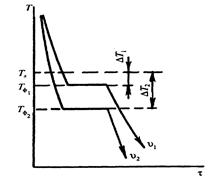
Рис.2.2. Кривая охлаждения чистого металла
До точек Тф1, Тф2 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. Затем идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждения).
Механизм и закономерности кристаллизации металлов
Процесс кристаллизации состоит из трех элементарных процессов: 1) зарождения центров кристаллизации; 2) роста кристаллов из этих центров; 3)слияния центров кристаллизации и образования зерен.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела.
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис. 2.3).
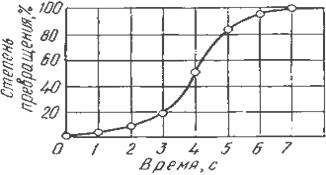
Рис. 2.3. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы, уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
В свою очередь, число центров кристаллизации и скорость роста кристаллов зависят от степени переохлаждения (рис. 2.4.).
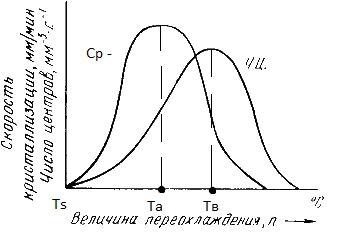
Рис. 2.4. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей Та, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей Тв – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых.