Синтез циклопропанов путем [2 + 1]-циклоприсоединения
Синтез трехчленных циклов по схеме циклоприсоединения должен, очевидно, включать взаимодействие непредельного субстрата, например алкена, с каким-либо Срреагентом, выступающим в роли синтетического эквивалента карбена 395 или его замещенных производных (схема 2.132).
 Схема 2.132
Схема 2.132
|
Карбены — крайне нестабильные, реакционноспособные частицы [33а], которые можно зафиксировать лишь в аргоновой матрице при низких температурах (ниже 77К) [ЗЗЬ]. Некоторые сведения о природе их реакционной способности удалось получить из данных по газофазным превращениям [33с]. В большинстве методов синтеза циклопропанов, формально описываемых как присоединение карбена, на самом деле в реакции с непредельным субстратом участвует не карбен, как таковой, а какой-либо реагент, который выступает в роли переносчика карбена. При этом далеко не во всех случаях можно считать, что в таких реакциях карбен может действительно образовываться, хотя бы в качестве интермедиата [33d]. Поэтому часто используют более нейтральный термин — карбеноид, подразумевающий, что эффективным итогом реакции с рассматриваемым интгрмедиатом является перенос карбена, т. е. в уже привычных читателю терминах такой интермедиат, равно как и его предшественник, являются синтетическими эквивалентами карбена. Типичные реакции, используемые для генерации такого рода ин-термедиатов, представлены на схеме 2.133.
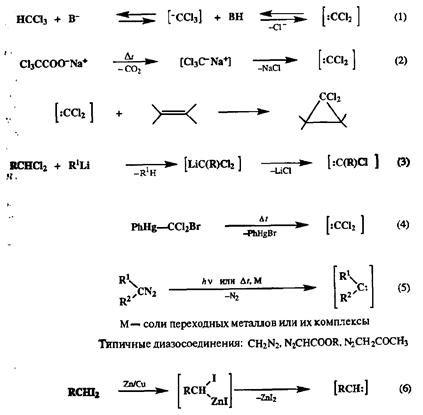 Схема 2.133
Схема 2.133
|
Среди показанных на схеме 2.133 реакций препаративно наиболее важна реакция (1), для которой разработана очень удобная методика проведения в условиях межфазного катализа. Согласно этой методике, раствор непредельного субстрата в хлороформе перемешивают с водным раствором щелочи в присутствии катализатора фазового переноса, например тетрабутиламмониевой соли. При этом на границе раздела фаз происходит генерация дихлоркарбена, который немедленно реагирует с субстратом, содержащимся в хлороформном слое. Альтернативный путь генерации дихлоркарбена, не требующий использования основания или каких-либо катализаторов, основан на декарбоксилировании трихлорацегата натрия при умеренном нагревании (2). Метод (3) является менее общим, и его используют обычно в случае внутримолекулярных вариантов [2 + 1]-циклоприсоединения. Метод (4) удобен для исследований, направленных на выяснение особенностей механизма реакций с участием дихлоркабе-нов. Как видно, методы (1), (2) и (4) ориентированы на генерацию дихлоркар-бенов, и, следовательно, в результате реакций получаемых реагентов с алкена-ми будут образовываться дихлорциклопропаны. Последние достаточно легко могут быть превращены в монохлорпроизводные или соответствующие углеводороды, так что по своему конечному результату использование этих реагентов и реакций эквивалентно циклопропанированию с помощью карбена.
Диазомеган, равно как и многие замещенные диазоалканы, широко применяются для циклопропанирования, поскольку под действием света или при нагревании в присутствии солей тяжелых металлов (Си, Rh) из них легко генерируются карбены {реакция (5)] [ЗЗе]. Однако простейшие диазоалканы не могут долго храниться даже в растворах, и каждый раз их приходиться получать из таких предшественников, как N-нитрозометилмочевина или ее аналоги. Напротив, производные диазоалканов, содержащие электроноакцепторные заместители, такие, как диазоуксусный эфир или диазоацетон, достаточно стабильны и удобны в применении для синтеза замешенных циклопропанов.
Наконец, к числу препаративно удобных методов циклопропанирования относится также реакция Симмонса—Смита, в которой в качестве синтетического эквивалента карбена используется карбеноидная частица ICH(R)ZnI, генерируемая in situ при действии цинк-медной пары на 1,1-ди-иодалканы [реакция (6)] [33f,g].
Некоторые примеры циклопропанирования с помощью рассмотренных методов показаны на схеме 2.134.
 Схема 2.134
Схема 2.134
|
транс-Хризантемовая кислота (396),природный инсектицид, как и многочисленные синтетические аналоги этого соединения, чаще всего получают по схеме циклопропанирования с использованием почти всего спектра реагентов, упоминавшихся выше. Некоторые из полученных веществ нашли широкое применение как эффективные и экологически чистые инсектициды. На схеме 2.134 представлен один из первых синтезов 396,основанный на моноциклопропанировании 2,5-диметилгексадиена-2,4 [33h].
Показанный на этой же схеме синтез трициклического углеводорода 397из гексадиена-1,5 включает последовательность двух реакций циклопропанирования, межмолекулярной и внутримолекулярной [33i]. Исходный реагент, бромоформ СНВгз, используется в первой из этих реакций как предшествен-никдибромкарбена. Из получаемого на этой стадии дибромциклопропана 397адалее под действием BuLi снова генерируется карбеноидная частица, реагирующая со второй двойной связью. Суммарный итог этих двух реакций соответствует использованию СНВгз в качестве эквивалента тетрадентатного синтона — бис-карбена :С:.
Примером эффективности внутримолекулярного [2 + 1]-циклоприсоеди-нения для построения полициклических систем, содержащих циклопропа-новый фрагмент, может служить синтез [3,1 ]-бициклогексанового производного 398[33j]. Требуемые для подобной циклизации диазокетоны могут быть легко получены по достаточно тривиальной реакции хлорангидридов с ди-азометаном.
Условия циклопропанирования по Симмонсу—Смиту |33f] особенно удобны для применения к енолъным производным, таким, как силиловые эфйры 399.Производные типа показанного на схеме 2.134 силилового эфира 400находят разнообразное применение в синтезе как замаскированные эквиваленты нестабильного циклопропанола. Помимо этого, такие эфиры являются промежуточными продуктами при секо-алкилировании — методе селективного введения одного алхильного заместителя в ct-положение кетонов, основанного на кислотном расщеплении трехчленного цикла силило-вых эфиров типа 400,что непосредственно приводит к ос-алкилкетояам.
Отметим в заключение этого раздела, что методы циклопропанирования самых различных алкеновых производных в целом очень хорошо отработаны. Поэтому, если целевая структура содержит циклопропанозое кольцо, то можно с уверенностью включать в число рассматриваемых вариантов ретро-синтеза те из них, которые предусмативают разборку по этому фрагменту.