Приготовление рабочего титрованного раствора перманганата калия
По свойствам кристаллический перманганат калия не относится к исходным веществам, поэтому точную концентрацию раствора устанавливают путем титрования. Рабочим раствором, пригодным для установления точной концентрации, может быть приготовленный титрованный раствор щавелевой кислоты, являющийся восстановителем. В процессе получения титрованного раствора необходимо учесть, что это вещество лучше растворяется в горячей воде, а концентрация его в первые дни после приготовления изменяется вследствие медленного окисления перманганатом восстановителей и микроорганизмов, возможно содержащихся в дистиллированной воде. Некоторые продукты этой химической реакции, например, MnO2 нерастворимы.
Учитывая сказанное, можно рекомендовать порядок приготовления рабочего титрованного раствора:
1) рассчитать массу перманганата калия, необходимую для получения 1 л раствора с молярной концентрацией эквивалента равной 0,1 моль/л;
2) взвесить кристаллический перманганат калия на технохимических весах с точностью до 0,01 г, перенести в мерную колбу на 1,0 л, растворить в горячей дистиллированной воде, охладить, довести объем раствора до метки дистиллированной водой комнатной температуры;
3) дать раствору постоять в темном месте 7-10 дней;
4) раствор перманганата отфильтровать через стеклянный фильтр или слить с помощью сифона в чистую сухую склянку;
5) для установления точной концентрации раствора приготовить 100 мл 0,1 моль/л раствора щавелевой кислоты. Способ приготовления известен из работы по методу нейтрализации. В отчете по данной работе записать расчет навески, все данные при взвешивании на аналитических весах, расчет точной концентрации;
6) установить точную концентрацию раствора по рабочему титрованному раствору щавелевой кислоты путем титрования в кислой среде. Для титрования раствором перманганата калия желательно применять бюретки со стеклянными кранами, т.к. перманганат окисляет резину.
Бюретку ополоснуть и заполнить раствором перманганата калия. В коническую колбу для создания кислой среды налить 5 мл раствора серной кислоты (1:4) и 10 мл приготовленного раствора щавелевой кислоты. Жидкость в колбе нагреть на водяной бане до 70-800С, но не до кипения, т.к. при кипении щавелевая кислота разлагается. Нагревание раствора ускоряет реакцию. Прикапывание раствора перманганата к горячему раствору щавелевой кислоты проводить сначала медленно, т.к. первые капли обесцвечиваются не сразу. Не следует прибавлять в раствор следующую каплю, пока предыдущая не обесцветится. Как только в растворе образуется небольшое количество ионов двухвалентного марганца, который является катализатором в этой реакции, дальнейшее обесцвечивание происходит почти мгновенно. Титрование заканчивается в тот момент, когда содержимое колбы примет едва заметный на белом фоне бледно-розовый цвет от одной капли раствора KMnO4.
Титрование повторить трижды, записать V1(KMnO4), V2(KMnO4), V3(KMnO4) и вычислить средний объем;
7) составить уравнение реакции, протекающей при титровании. Коэффициенты подобрать одним из известных способов;
8) вычислить нормальную концентрацию и титр раствора перманганата калия;
9) установленный титрованный раствор KMnO4 сохранить для выполнения следующих лабораторных работ;
10) для самоконтроля составить уравнение реакций при титровании перманганатом в нейтральной и щелочной средах. Вычислить для этих случаев молярные массы эквивалентов перманганата калия.
Расчётные формулы:
1) 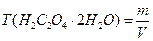
2) 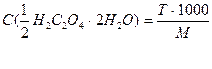
3) 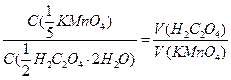
4) 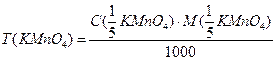
5 Лабораторная работа № 4
Перманганатометрия. Определение массовой доли железа в соли Мора
Метод перманганатометрии может быть использован для количественного определения железа в его соединениях. Сущность реакции
заключается в том, что соли, содержащие Fe2+, окисляются перманганатом в соли, содержащие Fe3+. Окислительно-восстановительная реакция осуществляется в кислой среде при обычной температуре.