рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Реферат Курсовая Конспект
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ - раздел Образование, Министерство Образования Российской Федерации...
Министерство образования Российской Федерации
Государственное образовательное учреждение
Высшего профессионального образования
«Оренбургский государственный университет»
Кафедра химии
Л.М. Рагузина, А.В. Стряпков, Е.В.Сальникова,
Ж.П. Анисимова
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ЛАБОРАТОРНОМУ ПРАКТИКУМУ
Рекомендовано к изданию Редакционно-издательским советом
Государственного образовательного учреждения
высшего профессионального образования
«Оренбургский государственный университет»
Оренбург 2003
ББК 24.4 я73
К - 60
УДК 54.062 (075.8)
Рецензент
кандидат технических наук, доцент Т.Ф. Тарасова
Количественный анализ.: Методические указания к
К 60 лабораторному практикуму./ Л.М. Рагузина, А.В. Стряпков,
Е.В. Сальникова, Ж.П. Анисимова. - Оренбург: ГОУ ОГУ,
С.
Лабораторный практикум состоит из лабораторных работ по количественному анализу. Каждая работа включает теоретическое изложение материала, описание методики проведения опытов, расчётные формулы.
Методические указания предназначены для выполнения
лабораторного практикума по дисциплине “Аналитическая химия” для студентов специальностей 011000, 320700, 271400, 270300, 270500, 271200, 271100, 2709000.
ББК 24.4 я73
© Рагузина Л.М., 2003
Стряпков А.В.,
Сальникова Е.В.,
Анисимова Ж.П.,
© ГОУ ОГУ, 2003
Содержание
1 Введение в объёмный анализ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
2 Лабораторная работа № 1
Метод нейтрализации. Приготовление рабочего титрованного
раствора кислоты. Приготовление рабочего титрованного раствора
щелочи. Определение концентрации кислоты по щелочи . . . . . . . . . . . . 12
3 Лабораторная работа № 2
Метод нейтрализации. Количественное определение карбонатов и
бикарбонатов в растворе . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
4 Лабораторная работа № 3
Оксидиметрия. Перманганатометрия. Приготовление рабочего
титрованного раствора перманганата калия . . . . . . . . . . . . . . . . . . . . . . . . .18
5 Лабораторная работа № 4
Перманганатометрия. Определение массовой доли железа в соли
Мора . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .21
6 Лабораторная работа № 5
Оксидиметрия. Иодометрия. Приготовление рабочего титрованного
раствора тиосульфата натрия. Определение массовой доли меди в
медном купоросе методом иодометрии . . . . . . . . . . . . . . . . . . . . . . . . . . . .23
Лабораторная работа № 6
Дихроматометрия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .27
Лабораторная работа № 7
Определение железа с трилоном Б . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29
Определение содержания уксусной кислоты в уксусе . . . . . . . . . . . . . . . 30 10 Лабораторная работа № 9 Определение степени гидролиза методом измерения рН раствора . . . . . .32Мерные колбы
Мерные колбы представляют собой плоскодонные сосуды шарообразной или грушеобразной формы с узким длинным горлом. На горле имеется кольцевая метка,… Наиболее часто применяют мерные колбы емкостью: 1000, 500, 250, 200, 100 и 50… Мерные колбы применяют для приготовления известных объемов растворов точной или примерно заданной концентрации, реже –…Правила обращения с мерными колбами
1.2.2.1 Работать с совершенно чистой колбой. 1.2.2.2 Колбу брать только за горло и обязательно выше метки, чтобы не… 1.2.2.3 Раствор или воду наливать до метки, чтобы вогнутый мениск жидкости касался кольцевой метки своей нижней…Пипетки
Применяются для точного отмеривания и перенесения из одного сосуда в другой небольших объемов растворов. При этом пипетки с расширением (пипетки…Правила обращения с пипетками
1.2.4.1 Работать с совершенно чистой пипеткой. 1.2.4.2 При высасывании воздуха из пипетки оттянутый носик должен быть до дна… 1.2.4.3 Как только раствор в пипетке поднимается выше метки, быстро вынуть верхний конец изо рта и закрыть отверстие…Бюретки
Бюретки представляют собой градуированные по высоте на мл и их доли длинные стеклянные трубки с оттянутым носиком, перед которым имеется стеклянный кран или отрезок резинового шланга, перекрываемые металлическим зажимом снаружи или стеклянным шариком внутри.
Бюретка предназначена для титрования или для отмеривания небольших порций растворов в серийных анализах.
Правила пользования бюретками
1.2.6.2 Бюретку укреплять в штативе строго вертикально при помощи металлических лапок или специальных зажимов. 1.2.6.3 Перед каждым титрованием обязательно заполнять бюретку раствором до… 1.2.6.4 При всех отсчетах по бюретке глаза наблюдателя располагать строго на уровне мениска жидкости.Растворы в объемном анализе, их классификация, способы
выражения и расчёта концентрации
1.3.1 По роли в объемном анализе различают рабочий и анализируемый растворы.
Рабочий раствор – это раствор того вещества, по концентрации которого устанавливают концентрацию анализируемого раствора.
Растворы с известной концентрацией в весовом анализе называют титрованными, т.е. с известным титром.
Титр – один из способов выражения концентрации растворов, показывает, сколько г (или мг) растворенного вещества содержится в 1 мг раствора. Обозначается Т, измеряется в г/мл или мг/мл. Является одним из видов массовой концентрации.
1.3.2 По способу нахождения точной концентрации титрованные растворы делят на два типа:
а) приготовленные;
б) установленные.
Приготовленным раствором называется титрованный раствор, точная концентрация которого становится известной в процессе его приготовления по точной навеске, взятой на аналитических весах, и точному объему раствора:
T (A) = m (A)/V (A), г/мл
Навеску вещества рассчитывают заранее. Масса вещества, необходимая для приготовления заданного объема раствора, заданной концентрации (или масса вещества, содержащаяся в любом объеме раствора известной концентрации) прямо пропорциональна концентрации, молярной массе или молярной массе эквивалента растворенного вещества и объему раствора.
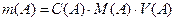 г, мг;
г, мг;
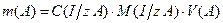 г, мг.
г, мг.
Кроме титра рабочего раствора
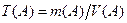 (г/мл)
(г/мл)
часто применяют в расчетах титр рабочего раствора вещества (А) по определяемому иону или веществу (Х).
Титр рабочего раствора по определяемому иону или веществу показывает, сколько г (мг) определяемого иона или вещества (Х) взаимодействует с 1 мл рабочего титрованного раствора вещества (А). Обозначается Т(А/Х). Например, Т(KMnO4/Fe2+) показывает, сколько г взаимодействует Fe2+ взаимодействует с 1 мл рабочего титрованного раствора KMnO4;
Т(AgNO3/Cl-) – титр рабочего раствора нитрата серебра по иону Cl-, показывает, сколько г Cl- взаимодействует с 1 мл рабочего титрованного раствора.
Титр Т(А/Х) вычисляется:
1) по затраченному на титрование объему рабочего раствора
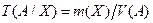 , г/мл,
, г/мл,
где m (Х)– масса титруемого иона или вещества, г
V (А)– эквивалентный объем рабочего раствора, мл
2) по концентрации рабочего титрованного раствора:
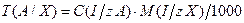 ,
,
например:
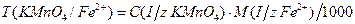 (гмл)
(гмл)
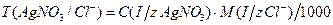 (г/мл)
(г/мл)
Вещества, пригодные для получения приготовленных растворов, называется исходным и должны удовлетворять следующим требованиям:
а) быть химически чистым,
б) иметь определенный химический состав, выражающийся одной формулой и не изменяющийся как при хранении веществ, так и при приготовлении раствора.
Круг таких веществ ограничен (поваренная соль; кристаллогидрат щавелевой кислоты, некоторые квасцы, бура и др.).
Большинство же веществ в той или иной мере изменяются со временем, поэтому для получения из них растворов с точной концентрацией вначале готовят раствор примерной концентрации, а затем устанавливают его точную концентрацию путем титрования.
Установленным раствором называется титрованный раствор, точная концентрация которого стала известной из расчетов по результатам титрования.
Расчет ведут на основании закона эквивалентов, который в применении к веществам, взаимодействующим в растворенном состоянии, можно сформулировать так: “Объемы растворов реагирующих веществ в точке эквивалентности обратно пропорциональны нормальным концентрациям этих веществ (или молярным концентрациям эквивалентов этих веществ)”. Для реакции
А + В → С + Д
где V (A), V (B) – объемы рабочего и анализируемого раствора в точке эквивалентности;
C (1/zA), C (1/zB)– нормальные концентрации рабочего и анализируемого раствора (или молярные концентрации эквивалентов этих веществ).
Нормальная или молярная концентрация эквивалентов показывает, какое количество вещества эквивалента содержится в единице объема раствора. Измеряется в моль/л, ммоль/мл.
Рекомендуется применять целые единицы измерения (моль/л), т.к. пропорциональные дробные величины численно с ними совпадают. Например, если имеется раствор с молярной концентрацией эквивалентов 0,1 моль/л, то его концентрация в ммоль/л также равна 0,1.
Нормальная концентрация (молярная концентрация эквивалента) находится отношением количества вещества эквивалента (n моль), содержащегося в растворе, к объему, этого раствора (V л).
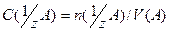
или учитывая, что
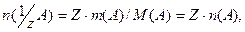
можно вычислить:
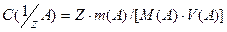
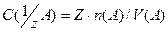
1.4 Вычисления в объёмном анализе
Вычисления в объемном анализе основаны на законе эквивалентов, законе сохранения массы вещества при химических реакциях, законе постоянства состава веществ. В расчетах используются числовые данные периодической системы химических эквивалентов Д.И. Менделеева или справочные таблицы относительных молекулярных масс элементов и различных формульных единиц.
Примеры типовых задач и расчетов в объемном анализе
1.4.1.1 Какова масса двухводного кристаллогидрата щавелевой кислоты, необходимая для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,1500 моль/л? Каков титр этого раствора?
Решение:
1) М (Н2С2О4 · 2Н2О) = 126,07 г/моль (из справочной таблицы)
2) Z = 2, 1/z = ½ = 0,5
3) m (Н2С2О4 · 2Н2О) = C (½Н2С2О4 · 2Н2О) · M (½Н2С2О4 · 2Н2О) · V (Н2С2О4)
m (Н2С2О4 · 2Н2О) = 0,1500 моль/л · ½ · 126 г/моль · 0,2 л = 1,8900 г.
4) Т (Н2С2О4 · 2Н2О) = m (Н2С2О4 · 2Н2О)/ V (Н2С2О4)
Т (Н2С2О4 · 2Н2О) = 1,8900 г/200 мл = 0,009450 г/мл
Ответ: m (Н2С2О4 · 2Н2О) = 1,8900 г.
Т (Н2С2О4 · 2Н2О) = 0,009450 г/мл.
1.4.1.2 Каковы титр и нормальная концентрация раствора серной кислоты, если на титрование 15,0 мл его затрачено 13,7 мл титрованного раствора гидроксида калия с молярной концентрацией 0,1304 моль/л?
Решение:
1) H2SO4 + 2 KOH → K2SO4 + 2 H2O
Z (H2SO4) = 2, 1/z = ½ = 0,5
Z (KOH) = 1
По закону эквивалентов:
V (H2SO4)/ V (KOH) = C (KOH) / C (½H2SO4)
C (½H2SO4) = 0,1304 моль/л · 13,7 мл / 15,0 мл = 0,1191 моль/л
2) Т(H2SO4) = С (½H2SO4) · М(½H2SO4) / 1000,
М (½H2SO4) = ½ · 98,078 = 49, 039 г/моль
Т (H2SO4) = 0,1191 моль/л · 49,03 г/моль/1000 мл = 0,005836 г/мл
Ответ: C (½H2SO4) = 0,1191 моль/л
Т (H2SO4) = 0,005836 г/мл
1.4.1.3 Из навески 0,6172 г иодида калия приготовили 100 мл раствора. На титрование 15,0 мл этого раствора затрачено 25,0 мл раствора нитрата серебра, молярная концентрация которого равна 0,0204 моль/л. Вычислите массовую долю иода в иодиде калия по результатам титрования и теоретическую (для сравнения).
Решение:
KI + AgNO3 → AgI + KNO3
1) T (AgNO3/I-) = C(AgNO3) · M(I-)/1000
T (AgNO3/I-) = 0,0204 моль/л · 127 г/моль /1000 мл = 0,002591 г/мл
2) m (I-) = T (AgNO3/I-) · V (AgNO3) · V1 (KI)/V2 (KI)
m (I-) = 0,002591 г/мл · 25 мл · 100 мл / 15 мл = 0,4318 г.
3) W (I-) = m (I-) / m (KI)
по результатам титрования:
W (I-)прак. = 0,4318 г / 0,6172 г = 0,6996 или 69,96 %
W (I-)теор. = М (I-) / М (KI)
W (I-)теор. = 127 г/моль / 166 г/моль = 0,7651 или 76,51 %
Ответ: W (I-)прак. = 0,6996 или 69,96 %
W (I-)теор. = 0,7651 или 76,51 %
Решить самостоятельно задачи
1.4.2.2 Какова масса сульфата меди в 2,5 л раствора с молярной концентрацией эквивалента 0,25 моль/л? Вычислите для безводной соли и пятиводного… 1.4.2.3 Каковы титр и молярная концентрация эквивалента раствора нитрита…Лабораторная работа № 1
Метод нейтрализации. Приготовление рабочего титрованного раствора кислоты. Приготовление рабочего титрованного раствора щелочи. Определение концентрации кислоты по щелочи
Введение
Метод нейтрализации или кислотно-основное титрование является одним из методов объемного химического количественного анализа аналитической химии. Основан на применении реакций нейтрализации в целях анализа. Сущность реакции нейтрализации заключается во взаимодействии протонов с гидроксид-ионами, в результате чего образуются слабодиссоциирующие молекулы:
H+ + OH- 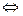 H2O
H2O
Методом нейтрализации устанавливают концентрацию растворов кислот по рабочим титрованным растворам щелочей; концентрацию растворов щелочей по рабочим титрованным растворам кислот; концентрацию растворов гидролитически кислых солей (11) по рабочим титрованным растворам щелочей; концентрацию гидролитически щелочных солей (11) по рабочим титрованным растворам кислот.
Так как реакции нейтрализации обычно не сопровождаются каким-либо внешним эффектом, точку эквивалентности при титровании фиксируют на глаз по изменению цвета добавленного к титруемому раствору индикатора. В методе нейтрализации применяются кислотно-основные индикаторы, изменение цвета которых происходит при изменении реакции среды. Наиболее распространенными индикаторами метода нейтрализации являются:
Таблица 1 – Кислотно-основные индикаторы
| № | Индикатор | Интервал перехода pH | Окраска молекулярной формы | Окраска ионной формы | Окраска в интервале перехода |
| Метиловый оранжевый | 3,1 – 4,4 | красная | желтая | оранжевая | |
| Метиловый красный | 4,4 – 6,2 | красная | желтая | оранжевая | |
| Фенолфталеин | 8,0 – 10,0 | бесцветная | малиновая | бесцветная – бледно-розовая | |
| Лакмус | 5,0 – 8,0 | красная | синяя | фиолетовая |
Приготовление рабочего титрованного раствора щавелевой кислоты
1) рассчитать навеску, необходимую для получения 100 мл раствора с нормальной концентрацией 0,1 моль/л; Для правильного определения z составить структурную формулу вещества. Расчет… 2) взвесить на аналитических весах на часовом стекле навеску, близкую к рассчитанной, с точностью до 0,0001 г. При…Лабораторная работа № 2
Метод нейтрализации. Количественное определение карбонатов и
Бикарбонатов в растворе
Метод нейтрализации используется не только для определения концентраций кислот и щелочей, но также для количественного определения солей, которые в растворе при гидролизе создают либо кислую, либо щелочную среду.
Количественное определение содержания карбоната натрия в растворе
Na2CO3 + HOH ↔ NaHCO3 + NaOH,Лабораторная работа № 3
Оксидиметрия. Перманганатометрия. Приготовление рабочего титрованного раствора перманганата калия
Перманганатометрия
Оксидиметрия или окислительно-восстановительное титрование является одним из методов объемного химического количественного анализа аналитической… Перманганатометрия – это частный случай оксидиметрии, основанный на применении… Перманганат калия KMnO4 в химических реакциях служит окислителем. Растворы перманганата калия окрашены в…Приготовление рабочего титрованного раствора перманганата калия
Учитывая сказанное, можно рекомендовать порядок приготовления рабочего титрованного раствора: 1) рассчитать массу перманганата калия, необходимую для получения 1 л раствора… 2) взвесить кристаллический перманганат калия на технохимических весах с точностью до 0,01 г, перенести в мерную колбу…Ход определения
5.1.1 Составить уравнение реакции между сульфатом железа (II) и перманганатом калия в сернокислой среде. 5.1.2 Пользуясь составленным уравнением, определить числа эквивалентности,… 5.1.3 Составить уравнение реакции между солью Мора, имеющей формулу и перманганатом калия в сернокислой среде.Оксидиметрия. Иодометрия. Приготовление рабочего титрованного раствора тиосульфата натрия. Определение массовой доли меди в медном купоросе методом иодометрии.
Сущность метода иодометрии
Атомы иода, принимая электроны от веществ – восстановителей, ведут себя в реакциях как окислители: I2o +2е → 2 I-Приготовление рабочего раствора тиосульфата натрия
Этапы приготовления: 1) рассчитать навеску тиосульфата натрия, необходимую для приготовления 100 мл… 2) взять навеску, близкую к рассчитанной, на технохимических весах с точностью до 0,01 г;Определение массовой доли меди в медном купоросе методом иодометрии
Йодометрическое определение меди в медьсодержащих веществах основано на взаимодействии катионов Cu2+ с анионом I-. CuSO4 + KI → CuI + I2 + K2SO4 (5)Определение железа
Титрование железа (II) основано на реакции: 6Fe2++Cr2O72-+14H+= 6Fe3++2Cr3++7H2OЛабораторная работа № 7
Определение железа с трилоном Б
В сильнокислой среде при рН<0,9 комплексы железа (III) с трилоном Б (ЭДТА) образуются в соответствии с уравнением: Fe3++H5Y+=FeHY+4H+Лабораторная работа № 8
Определение содержания уксусной кислоты в уксусе
Оттитровано уксусной кислоты, % 90 99 99,9 100 100,1 101Ход определения.
1 мл 0,1 моль/л раствора NaOH соответствует 0,0060 г уксусной кислоты. Содержание уксусной кислоты (m, г/100 мл уксуса) рассчитывают по формуле m = (V(NaOH)·С(NaOH)∙0,06∙100∙100)/V1V2= V(NaOH) ·С(NaOH)·600/ V1V2,Лабораторная работа № 9
Определение степени гидролиза методом измерения рН раствора
Количественно реакция гидролиза оценивается величинами степени гидролиза h – долей электролита, подвергнувшейся гидролизу, и константы гидролиза Кг.… Кг = h2с / (1 - h) (9)Метод комплексообразования. Трилонометрия. Определение общей
жёсткости воды методом комплексонометрии
Сущность метода комплексообразования
В аналитической химии часто применяют комплексон – двунатриевую соль этилендиаминтетрауксусной кислоты HOOCH2C CH2COOHПрименение метода трилонометрии для определения общей
Жесткости воды
Для определения общей жёсткости к исследуемому объёму воды добавляют буферную смесь для создания щелочной среды (рН = 10) и раствор индикатора,… В растворе индикатора при рН = 7 – 11 устанавливается равновесие:Приготовление рабочего титрованного раствора трилона Б
11.3.2 Взять навеску кристаллогидрата трилона Б на аналитических весах, соблюдая правила взвешивания и ведя соответствующую запись. 11.3.3 Перенести навеску в мерную колбу на 100,0 мл, соблюдая правила… 11.3.4 Рассчитать титр и молярную концентрацию эквивалента приготовленного рабочего раствора трилона Б.Экспериментальная часть.
Приборы и посуда: аналитические весы, тигли, муфельная печь.
Реактивы: пищевая кислота, раствор нитрата аммония (NH4NO3), 10 %.
Ход выполнения.
Результаты записывают в таблицу.
Таблица 3 - Результаты взвешивания тигля в ходе анализа Показания Обозначение Результаты взвешивания … Содержание золы вычисляется по формуле:Весовой анализ. Определение массовой доли бария в хлориде бария весовым методом осаждения
а) расчет навески и взятие ее на аналитических весах; б) растворение навески; в) осаждение искомого компонента (иона) в составе практически нерастворимого вещества;Осаждение катиона бария
13.2.1 Приготовить раствор осадителя, смешав 30,0 мл дистиллированной воды и 3,0 – 5,0 мл. раствора серной кислоты С (½H2SO4) = 2 моль/л в… 13.2.2 Анализируемый раствор и раствор осадителя нагреть на плитке почти до… 13.2.3 Провести осаждение иона бария. Для этого медленно, при постоянном перемешивании приливать по каплям горячий…Прокаливание тигля до постоянной массы
13.3.2 Перенести тигель тигельными щипцами в эксикатор и дать охладиться до комнатной температуры. 13.3.3 Взвесить тигель на аналитических весах с точностью до 0,0001 г. Массу и… 13.3.4 Повторить прокаливание в течение 10 – 15 минут, охладить в эксикаторе и снова взвесить.Фильтрование и промывание осадка
13.4.1 Плотный беззольный фильтр «синяя лента» хорошо подогнать к воронке. Воронку с фильтром поместить в кольцо штатива и подставить под него… 13.4.2 Декантировать всю прозрачную жидкость с осадка на фильтр по стеклянной… 13.4.3 Приготовить промывную жидкость: нагреть в промывалке 250 – 300 мл дистил. воды с добавлением 4 – 5 капель…Высушивание и прокаливание осадка
13.5.2 Фильтр с осадком свернуть, чтобы осадок оказался внутри, поместить в фарфоровый тигель, прокаленный до постоянной массы, перенести в… 13.5.3 Прокаливание, охлаждение, взвешивание повторять до постоянной массы.… ВаSО4 + 2С = ВaS + 2CO2Вычисление результатов анализа
1) 3) 2) 4) 5) ошибка =Требования к рабочему журналу
Студенты обязаны придерживаться определенных правил оформления рабочего журнала, заключающихся в следующем: 1) для журнала используется общая тетрадь, страницы нумеруются, проводятся… 2) записи ведутся подробно и аккуратно;Список использованных источников
2. В.П.Васильев Аналитическая химия-М.: Высшая школа, 1989.-Т1.–320 с. 3. А.Т. Пилипенко, И.В. Пятницкий Аналитическая химия- М.: Химия, 1990.Т.1 –… 4. Основы аналитической химии. Практическое руководство: Пособие для вузов/ Под редакцией Ю.А. Золотова. – М.: Высшая…– Конец работы –
Используемые теги: Количественный, анализ0.05
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов