Определение степени гидролиза методом измерения рН раствора
Количественно реакция гидролиза оценивается величинами степени гидролиза h – долей электролита, подвергнувшейся гидролизу, и константы гидролиза Кг. Обе величины связанны следующим соотношением:
Кг = h2с / (1 - h) (9)
где с – молярная концентрация соли, моль/л.
В случае, когда степень гидролиза в растворе невелика (h < 0,01), при вычислениях пользуются приближёнными выражениями
Кг = h2с
или
h = 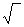 Кг/с, (10)
Кг/с, (10)
Если известны концентрации ионов водорода Δ[Н+] или гидроксида Δ[ОН-], образующихся за счёт реакции гидролиза, и исходная концентрация соли [МеА], то степень гидролиза рассчитываются hi с помощью следующих выражений:
h = Δ[Н+]/[МеА] (11),
h = Δ[ОН-]/[МеА] (12)
Обозначив концентрации ионов водорода в растворе соли [Н+]соли и в воде [Н+]Н2О, получим
Δ[Н+] = [Н+]cоли - [Н+]воды (13)
[Н+]соли и [Н+]Н2О можно рассчитывать, если известны величины рН в растворе соли и в воде, так как
рН = -lg[Н+] (14).
Пример: Предположим, значение рН для воды равно 6,5. Тогда lg[Н+] = -6,5. По данному логарифму находим число (антилогарифм), характеризующее концентрацию ионов водорода в воде: [Н+]Н2О = 3,2∙10-7 моль/л. Зная величину ионного произведения воды Кw
Кw = [Н+]∙[ОН-] = 10-14 (15),
рассчитывают
[ОН-] = 10-14/3,2∙10-7 = 3,1∙10-7 моль/л.
При рН раствора соли равном 2,8 lg[Н+] = -2,8. Концентрация ионов [Н+] в растворе соли будет
[Н+]соли = 1,6∙10-3 моль/л,
а Δ[Н+] = 1,6∙10-3 - 3,2∙10-3 = 1,59968∙10-3 моль/л.
Если исходная концентрация соли равна 0,1 моль/л, то степень гидролиза:
h = 1,9968∙10-3/0,1 = 1,6 %.
рН испытуемого раствора соли измеряется с помощью прибора рН-метра. Измерение рН основано на определении электродвижущей силы (э.д.с.) электрохимической цепи, состоящей из двух электродов. Потенциал электрода является логарифмической функцией концентрации ионов водорода:
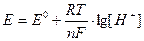
Следовательно, измерив величину э.д.с., можно определить величину рН исследуемого раствора.
Порядок работы.
Измерить величину рН раствора испытуемой соли (FeCl3, Na2CO3 и др.) и определить степень гидролиза этой соли.
Для этого сначала измерить на рН-метре рН дистиллированной воды, а затем рН испытуемой соли. Используя уравнение (14), рассчитать концентрацию ионов водорода (концентрацию ионов гидроксила рассчитывают по уравнению (15))в воде и в растворе соли, а затем по уравнению (13) рассчитать величину Δ[Н+]. По уравнению (11) (или (12) в случае щелочной среды) рассчитать степень гидролиза соли.
11 Лабораторная работа № 10