Выведите формулу константы растворимости.
Константа равновесия называется произведением растворимости ПР или константой растворимости KS. Как любая константа равновесия величина ПР зависит от температуры и не зависит от концентрации.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:

где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
3. Как выражают константу растворимости для идеальных и реальных систем? От чего зависит величина константы растворимости для этих систем?
Константа равновесия для идеальных систем может быть выражена через равновесные парциальные давления компонентов pi по формуле:

где νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры .
Константа равновесия для реальных систем
вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
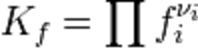

4. Как связаны термодинамическая, реальная и условная константы растворимости?
В системе, состоящей из раствора и осадка, идут два процесса - растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенныйраствор - это раствор, который находится в равновесии с осадком.
^Константа растворимости KS (или произведение растворимости ПР) - произведение концентраций ионов в насыщенном растворе малорастворимого электролита - есть величина постоянная и зависит лишь от температуры.
Способы выражения констант равновесия: термодинамическая и концентрационные (реальная, условная) константы.
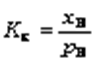
Кs – практическая константа. Такая константа называется константой растворимости
Условная константа - это константа какого-либо равновесия в вполне конкретных "отягчающих" условиях. По сути она может представлять собой, например, произведение реальной константы рассматриваемого равновесия на константу равновесия побочной реакции в случае, если они протекают последовательно. Либо эта зависимость может носить более сложный характер.
5. Как влияет одноименный ион на растворимость осадка?
Уменьшение растворимости. Абсолютно нерастворимых веществ нет. Все вещества растворимы в большей или меньшей степени. Добавление избытка осаждающего реактива при осаждении является одним из способов уменьшения растворимости осадков.
растворимость осадка при добавлении избытка осаждающего реактива уменьшается и зависит от избытка прибавленного иона, общего с одним из ионов, образующих осадок, а также от численного значения произведения растворимости данного малорастворимого электролита.
Аналогичным образом можно доказать, что (если малорастворимое вещество не растворяется с образованием комплексных соединений и не относится к амфотерным соединениям) растворимость малорастворимого электролита также понижается при добавлении не только осаждающего реактива, но и любого другого хорошо растворимого в данной среде электролита, имеющего общие ионы с малорастворимым веществом.
6. Почему при выделении осадка следует избегать большого избытка осадителя?
Иногда, если это необходимо, прибавляют значительно боль-шее (в 2-3 раза) количество осадителя. Однако слишком большой избыток осадителя вреден, т.к. он вызывает не понижение, а наоборот - повышение растворимости осадка. Причиной этого может быть образование растворимых комплексных соединений или кислых солей, амфотерность осаждаемого соединения (гидроксида), «солевой эффект» (вследствие возрастания ионной силы раствора) и т.д.
Необходимый объем осадителя рассчитывают по формуле:
 , (42)
, (42)
где ос.в. - осаждаемое вещество;
р.в. - реактив (реагент).
Этот расчет ориентировочный, поэтому полученное значение объема округляют до одной-двух значащих цифр.
7. Как влияют электролиты на растворимость осадка?
Применение слишком большого количества осадителя в ряде случаев оказывается недопустимым потому, что различные сильные электролиты, присутствующие в растворе, обычно повышают растворимость осадка.
Повышение растворимости осадков в присутствии электролитов называется солевым эффектом.
Это явление объясняется следующим образом.
Как известно из курса качественного анализа, произведение растворимости только в первом приближении можно рассматривать как произведение концентраций ионов в насыщенном растворе. В действительности же постоянным является произведение активностей (а не концентраций) ионов в насыщенном растворе.
Таким образом, активность ионов какого-либо электролита зависит не только от его концентрации в растворе, но и от концентраций и зарядов всех других присутствующих в растворе ионов.
в достаточно разбавленных растворах с одинаковой ионной силой коэффициенты активности большинства ионов, имеющих один и тот же заряд, приблизительно одинаковы.
8. Что называется растворимостью и молярной растворимостью?
РАСТВОРИМОСТЬ, способность в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением компонентов. Обычно растворителем считают в-во, к-рое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся р-р. Если до растворения оба в-ва находились в одном и том же агрегатном состоянии, р-рителем считается в-во, присутствующее в смеси в существенно большем кол-ве.
Молярная растворимость вещества (S, моль/л) - это количество растворенного вещества, содержащееся в одном литре его насыщенного раствора