рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Образование
- /
- Основные понятия
Реферат Курсовая Конспект
Основные понятия
Основные понятия - раздел Образование, Основные Понятия ...
Основные понятия
Задачи и методы аналитической химии.
В зависимости от задания, аналитическая химия подразделяется на качественный анализ, нацеленный на определение того, что или какие вещества, в какой… Методы: v Химические методы(Происходящее химическое превращение называется - аналитической реакцией, а вещество, его…Понятие о химических, физических, физико-химических (инструментальных) методах анализа. Ионная сила раствора. Активность, коэффициент активности.
v Физические методы-Они основаны на измерении какого-либо параметра системы, который является функцией состава. Например, спектральный анализ,… v Физико-химические методы-Из данных методов можно выделить колориметрический… Можно отметить еще один метод - биологический, который использует отклик организмов на изменения в окружающей среде. …Качественный химический анализ. Основные понятия. Предмет и средства. Чувствительность, специфичность, селективность.
Качественный анализ имеет своей целью обнаружение определенных веществ или их компонентов в анализируемом объекте. Качественный анализ всегда предшествует количественному.
В настоящее время к. а. выполняют инструментальными методами: спектральными, хроматографическими, электрохимическими и др. К химическим реакциям в качественном анализе предъявляют следующие требования.
1. Реакция должна протекать практически мгновенно.
2. Реакция должна быть необратимой.
3. Реакция должна сопровождаться внешним эффектом (АС):
а) изменением окраски раствора;
б) образованием или растворением осадка;
в) выделением газообразных веществ;
г) окрашиванием пламени и др.
4. Реакция должна быть чувствительной и по возможности специфичной.
Аналитические реакции, проводимые между твердыми веществами, относят к реакциям «сухим путем», а в растворах - «мокрым путем».
Селективность реакций можно повысить, изменяя их условия (рН) или применяя маскирование. Маскирование заключается в уменьшении концентрации мешающих ионов в растворе меньше предела их обнаружения, например путем их связывания в бесцветные комплексы.
Типы аналитических реакций:
V Макроанализ
V Полумикроанализ
V Микроанализ
Микрокристаллоскопический
Капельный
V Ультрамикроанализ
Исследованию подвергают количества вещества меньше 1 мг. Почти все операции анализа проводят под микроскопом.
Классификация катионов и анионов на группы. Аналитические группы катионов. Обзор реакций.
В качественном химическом анализе преимущественно имеют дело с водными растворами электролитов, поэтому аналитическими реакциями открывают образующиеся при диссоциации катионы и анионы. В форме катионов существуют элементы различных групп периодической системы, поэтому и аналитические свойства катионов различны. Однако с помощью групповых реактивов из общей смеси катионов можно выделить отдельные группы катионов со сходными аналитическими свойствами – аналитические группы. Применение разнообразных групповых реактивов позволило разработать различные аналитические классификации катионов (и анионов). Наибольшее распространение получили сульфидная, кислотно-основная и аммиачно-фосфатная классификации. По кислотно-основной классификации катионы делят на шесть аналитических групп.
Кислотно-основная классификация катионов
|
Количественный анализ. Предмет и методы.
Количественный анализ бывает трех видов: полный, частичный, общий. При полном количественном анализе устанавливается полный количественный состав… Методыколичественного анализа можно разделить на три большие группы:… Химические методы основаны на использовании количественно протекающих, различных по типу химических реакций: обменных,…Весовой анализ. Принципы и методы объемного анализа. Растворы в объемном анализе.
ОБЪЁМНЫЙ АНАЛИЗ, совокупность методов химического количественного анализа, основанных на измерении объёмов для установления концентрации…Метод нейтрализации. Кислотно-основные индикаторы. Смешанные индикаторы. Кривые титрования. Титрование в неводных средах.
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Индикаторы широко… Смешанный индикатор - это смесь двух разных индикаторов или смесь, состоящая… Кривые титрования в методе нейтрализации представляют собой графическое изображение изменения рН раствора в процессе…Хроматографический анализ. Классификация методов.
хроматографию можно определить как процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента.
Классификация методов хроматографии
По агрегатному состоянию фаз различаютжидкостную и газовую хроматографию.
По механизму взаимодействия вещества и сорбента различают сорбционные методы, основанные на законах распределения, гельфильтрационные, основанные на различии в размерах молекул разделяемых веществ.
По технике выполнения хроматографию подразделяют на колоночную, когда разделение веществ проводится в специальных колонках, и плоскостную: тонкослойную и бумажную.
В соответствии с режимом ввода пробы в хроматографическую систему различаютфронтальную, элюентную и вытеснительную хроматографию. Наибольшее распространение получил элюентный режим хроматографирования, позволяющий получать в чистом виде все компоненты пробы.
14. Жидкостная адсорбционная, ионообменная хроматография. Хроматография в тонком слое. Гель-хроматография.
Жидкостно-адсорбционная хроматография-Разделение смеси веществ в адсорбционной колонке происходит в результате различия их в сорбируемости на данном адсорбенте.Адсорбентами являются пористые тела с сильно развитой внутренней поверхностью, удерживающие жидкости с помощью межмолекулярных и поверхностных явлений.
Ионообменная хроматография-является разновидностью жидкостной хроматографии и в аппаратурном оформлении ничем не отличается от других видов жидкостной колоночной хроматографии. В основе ионообменной хроматографии лежит процесс обмена между ионами анализируемого раствора (ПФ) и подвижными ионами того же знака ионообменника (НФ).В качестве ионообменников или ионитов обычно используют синтетические полимерные вещества, называемые ионообменными смолами.
Тонкослойная хроматография (ТСХ) является одним из наиболее простых и эффективных экспресс-методов разделения и анализа веществ в пищевых продуктах, биологических жидкостях и других объектах, не требующих сложного оборудования. В то же время метод обладает высокой избирательностью и чувствительностью (низким пределом обнаружения). Этим методом можно определить 10-20 мкг вещества с точностью до 5-7%.В зависимости от природы НФ тонкослойная хроматография может быть адсорбционной и распределительной.
Гельпроникающая хроматография (ГПХ) представляет собой метод разделения молекул, основанный на различии из размеров.В качестве НФ в ГПХ используют частицы, имеющие определенные размеры пор. Это различного рода гели (мягкие, полужесткие и жесткие).
15. Спектральные методы исследования органических соединений (УФ-, ИК- и ЯМР-спектроскопия).
Одна из задач, стоящих перед химиками – определение структуры вещества.
Электронная, или УФ-спектроскопия-Электронные спектры поглощения наблюдаются в результате поглощения ультрафиолетового и видимого излучения; при этом происходит переход (возбуждение) валентного электрона с занимаемого им уровня на уровень с более высокой энергией.
Из всего спектра электромагнитного излучения глаз человека способен воспринимать лишь его небольшую «видимую» часть с длинами волн от 400 до 800 нм.
Ультрафиолетовая область спектра простирается от 1 до 400 нм.
Инфракрасная спектроскопия (ИКС) — раздел спектроскопии, охватывающий длинноволновую область спектра (>730 нм за красной границей видимого света). Инфракрасные спектры возникают в результате колебательного (отчасти вращательного) движения молекул, а именно — в результате переходов между колебательными уровнями основного электронного состояния молекул. ИК излучение поглощают многие газы, за исключением таких как О2, N2, H2, Cl2 и одноатомных газов. Поглощение происходит на длине волны, характерной для каждого определенного газа .По инфракрасным спектрам поглощения можно установить строение молекул различных органических (и неорганических) веществ.
Спектроскопи́я я́дерного магни́тного резона́нса, ЯМР-спектроскопия — спектроскопический метод исследования химических объектов, использующий явление ядерного магнитного резонанса. Подобно инфракрасной спектроскопии, ЯМР выявляет информацию о молекулярном строении химических веществ. Однако, он обеспечивает более полную информацию, чем ИС, позволяя изучать динамические процессы в образце — определять константы скорости химических реакций, величину энергетических барьеров внутримолекулярного вращения.
16. Электронная спектроскопия органических соединений (УФ-спектроскопия).
Электронная спектроскопия является очень чувствительным и удобным методом для определения спектров поглощения, пропускания или отражения, изучения кинетики реакции, сопровождающейся спектральными изменениями.
Электронные спектры поглощения наблюдаются в результате поглощения ультрафиолетового и видимого излучения; при этом происходит переход (возбуждение) валентного электрона с занимаемого им уровня на уровень с более высокой энергией. По типу поглощаемого излучения электронную спектроскопию часто называют спектроскопией в ультрафиолетовой и видимой области, или УФ-спектроскопией.
Из всего спектра электромагнитного излучения глаз человека способен воспринимать лишь его небольшую «видимую» часть с длинами волн от 400 до 800 нм.
Ультрафиолетовая область спектра простирается от 1 до 400 нм, однако, поскольку компоненты земной атмосферы поглощают излучение с длиной волны ниже 200 нм, под термином «ультрафиолетовые лучи» обычно понимают излучение с длиной волны 200-400 нм .
Для изучения области спектра от 1 до 200 нм необходимо использовать вакуумные устройства («область вакуумного ультрафиолетового излучения», «дальняя ультрафиолетовая область»).
Термины «ближняя и дальняя области» характеризуют положение по отношению к видимой области электромагнитного спектра. Солнечная радиация состоит в основном из опасного для жизни «вакуумного ультрафиолетового излучения», поэтому поглощение атмосферой излучения с длиной волны ниже 200 нм сохраняет жизнь на поверхности Земли.
17. Законы поглощения света веществом. Коэффициент молярной экстинции.
При прохождении излучения через раствор светопоглощающего вещества поток излучения ослабляется тем сильнее, чем больше энергии поглощают частицы данного вещества. Понижение интенсивности зависит от концентрации поглощающего вещества и длины пути, проходимого потоком.
коэффициентом пропускания:
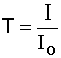 ,
,
где Io - интенсивность падающего потока света, I - интенсивность потока света, прошедшего через раствор.
Взятый с обратным знаком логарифм Т называют оптической плотностью А:
Уменьшение интенсивности излучения при прохождении его через раствор подчиняется закону Бугера - Ламберта - Бера:
- lg T = A = 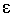
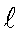 С , (5.3.)
С , (5.3.)
где 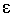 - молярный коэффициент поглощения,
- молярный коэффициент поглощения,  - толщина поглощающего слоя, см; С - концентрация раствора, моль / л.
- толщина поглощающего слоя, см; С - концентрация раствора, моль / л.
Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора с толщиной слоя 1см. Молярный коэффициент поглощения - индивидуальная характеристика вещества, он зависит от природы вещества и длины волны и не зависит от концентрации и длины кюветы.
18. Спектры поглощения органических соединений.
Спектр поглощения — зависимость показателя поглощения вещества от длины волны (или частоты, волнового числа, энергии кванта и т. п.) излучения. Он связан с энергетическими переходами в веществе. Для различных веществ спектры поглощения различны.
Спектрометры, предназначенные для измерения поглощения электромагнитного излучения образцом, содержат источник излучения, кювету с веществом, через которую пропускают излучение, и детектор. Частоту излучения непрерывно меняют, а интенсивность света, попадающего на детектор, сравнивают с интенсивностью источника. Когда частота падающего света достигает определенного значения, происходит поглощение излучения веществом. Детектор отмечает снижение интенсивности прошедшего через образец (кювету) света. Зависимость между частотой света и поглощением, записанная на бумаге в виде линии, называется спектром.
При исследовании органических соединений обычно используют поглощение ИК-излучения.
19. Возможности электронной спектроскопии в установлении строения органических соединений.
Возможности электронной спектроскопии в распознавании структурных изомеров иногда довольно убедительны.
При выявлении взаимосвязи спектра и структуры молекулы в электронной спектроскопии признается целесообразным наблюдение за изменениями в положении и интенсивности полосы поглощения при переходе от некоторого родоначального хромофора, ответственного за поглощение, к модифицированному путем введения в систему первого дополнительной хромофорной или ауксохромной группы.
В УФ-области поглощают все органические вещества. Как правило, «рабочая» область составляет интервал 190—730 нм, главным образом от 200 до 380 нм. В этих областях прозрачны оптические материалы для изготовления призм и кювет. Длины волн менее 190 нм (вакуумный ультрафиолет) менее удобен для работы, так как в этой поглощают компоненты воздуха — кислород и азот. Поэтому для работы в этой области используются специальные вакуумные камеры, что усложняет лабораторную практику, однако часто бывает незаменимым, например, при исследовании диэлектриков с большой величиной запрещенной зоны.
Спектры испускания (флуоресценция, фосфоресценция.)
1. Сплошные (непрерывные) спектры. В сплошном спектре представлены все цвета (длины волн), причем переход от одного цвета к другому совершается… 2. Линейчатые спектры. Линейчатым называют спектр, состоящий из отдельных… 3. Полосатые спектры. Состоят из отдельных полос, разделенных темными промежутками.Действие ИК-излучения на молекулы органических соединений. Возможности ИК-спектроскопии при изучении органических соединений.
Фиксируемые в ИК-спектрах полосы поглощения обусловлены переходами между колебательными энергетическими уровнями в молекулах вещества. Положение… Процедура анализа методом ИК-спектроскопии проста и не занимает много…Спектроскопия ядерного магнитного резонанса. Ядерный магнитный резонанс (ЯМР) и условия его возникновения.
Переходы между ядерными магнитными уровнями возможны для ядер, обладающих магнитным моментом, т.е. имеющих спиновое квантовое число 1, не равное… Первый спектр ЯМР наблюдал И. А. Раби с сотрудниками в 1934 г., они получили…Масс-спектрометрия органических соединений. Происхождение масс-спектров (ионизация молекул органических соединений при бомбардировке электронами, лазерного излучения и др.).
Масс-спектрометрия— метод исследования вещества, основанный на определении отношения массы к заряду ионов, образующихся при ионизации представляющих интерес компонентов пробы. Один из мощнейших способов качественной идентификации веществ, допускающий также и количественное определение. Можно сказать, что масс-спектрометрия — это «взвешивание» молекул, находящихся в пробе.
Масс-спектр — это зависимость интенсивности ионного тока (количества вещества) от отношения массы к заряду (природы вещества). Поскольку масса любой молекулы складывается из масс составляющих её атомов, масс-спектр всегда дискретен, хотя при низком разрешении масс-спектрометра пики разных масс могут перекрываться или даже сливаться. Природа анализируемого вещества, особенности метода ионизации и вторичные процессы в масс-спектрометре могут влиять на масс-спектр.
Большинство небольших молекул при ионизации приобретает только один положительный или отрицательный заряд. Чем больше молекула, тем больше вероятность того, что во время ионизации она превратится в многозарядный ион. Поэтому особенно сильно данный эффект проявляется в отношении крайне больших молекул. При некоторых видах ионизации молекула может распадаться на несколько характерных частей, что даёт дополнительные возможности идентификации и исследования структуры неизвестных веществ.
Рентгеноструктурный анализ органических соединений. Преимущества и недостатки метода рентгеноструктурного анализа в исследовании органических соединений.
методы исследования структуры вещества по распределению в пространстве и интенсивностям рассеянного на анализируемом объекте рентгеновского излучения. Р. с. а. наряду с нейтронографией и электронографией является дифракционным структурным методом; в его основе лежит взаимодействие рентгеновского излучения с электронами вещества, в результате которого возникает Дифракция рентгеновских лучей. Дифракционная картина зависит от длины волны используемых рентгеновских лучей и строения объекта. Для исследования атомной структуры применяют излучение с длиной волны, порядка размеров атомов. Методами Р. с. а. изучают металлы, сплавы, минералы, неорганические и органические соединения, полимеры, аморфные материалы, жидкости и газы, молекулы белков, нуклеиновых кислот и т.д. Наиболее успешно Р. с. а. применяют для установления атомной структуры кристаллических тел. Это обусловлено тем, что Кристаллы обладают строгой периодичностью строения и представляют собой созданную самой природой дифракционную решётку для рентгеновских лучей.
Рентгеновский метод позволяет надежно определять молекулярные веса белков; для этого необходимы хорошо образованные кристаллы белков, дающие возможность получать хорошие снимки.
Мониторинг окружающей среды. Общее понятие об источниках химического загрязнения окружающей среды и химических и физико-химических методов анализа воздуха, почвы, природной воды, бытовых и промышленных сточных вод.
Мониторинг окружающей среды— комплексная система долгосрочных наблюдений, оценки и прогноза изменения состояния окружающей среды под влиянием антропогенных факторов. Основными задачами мониторинга служат: наблюдение за состоянием биосферы, оценка и прогноз состояния природной среды, выявление факторов и источников антропогенных воздействий на окружающую среду, предупреждение о создающихся критических ситуациях, вредных или опасных для жизнедеятельности и здоровья людей и других живых организмов.
Химическое загрязнение – изменение естественного химического состава окружающей среды, вызванное превышением средних многолетних концентраций химических веществ, постоянно присутствующих в окружающей среде или привнесением в окружающую среду новых, чуждых ей веществ.
Данные методы используют для очистки от растворенных примесей, а в некоторых случаях и от взвешенных веществ. Многие методы физико-химической очистки требуют предварительного глубокого выделения из сточной воды взвешенных веществ, для чего широко используют процесс коагуляции.
В настоящее время в связи с использованием оборотных систем водоснабжения существенно увеличивается применение физико-химических методов очистки сточных вод, основными из которых являются:
1.флотация,2.сорбция,.ионообменная и электрохимическая очистка,
.гиперфильтрация,.нейтрализация,.экстракция,.эвапорация.
Методы анализа сточных и природных вод
Атомно-абсорбционная спектрометрия
Высокоэффективная жидкостная хроматография
Газовая хроматография, Гравиметрия, ИК- спектроскопия
ИСП-спектрометрия, Капиллярный электрофорез
Титриметрия, Фотометрия, Хромато-масс-спектрометрия и др
Закон действия масс и гомогенные системы
Активность отличается от общей концентрации на некоторую величину. Отношение активности () к общей концентрации вещества в растворе называется… Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения…Что такое константа диссоциации и степень диссоциации.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции… "Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на…ОВР
1. Какие реакции называются окислительно-восстановительными?
Окисли́тельно-восстанови́тельные реа́кции, ОВР— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
2. Что такое окислитель, восстановитель, окисление и восстановление?
Окисление — процесс отдачи электронов, с увеличением степени окисления. При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
3. Что называется электродным потенциалом?
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
4. Как влияет ионная сила на величину электродного потенциала?
На величину электродного потенциала влияют природа металла и растворителя. Чем меньше активность металла, тем меньшее количество электронов образуется на пластинке и тем меньший отрицательный заряд возникает на ней.
Количественная зависимость между концентрацией (активностью) компонентов обратимой окислительно-восстановительной ред-окс системы и величиной электродного потенциала выражается уравнением:
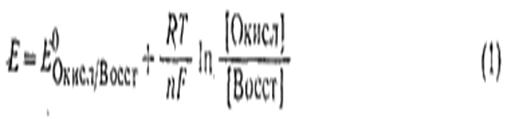
или
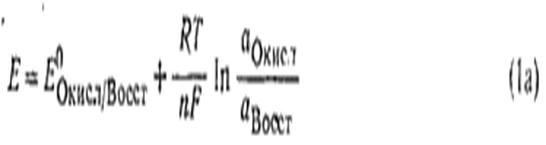
5. Как влияет рН среды на величину потенциала? Выведите формулу зависимости потенциала от рН для полуреакции, протекающей с участием ионов водорода или гидроксида.
Водоро́дный показа́тель, pH— мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр:
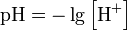
Окислительные процессы понижают показатель кислотно-щелочного равновесия (чем выше rН, тем ниже рН), восстановительные - способствуют повышению рН. В свою очередь показатель рН влияет на величину rH.
Уравнение Нернста:
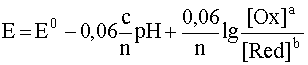
6. Как определить направление реакции окисления-восстановления и полноту ее протекания?
Прогноз направленности протекания окислительно-восстановительных реакций подчиняется единому правилу, действующему для всех донорно-акцепторных взаимодействий: реакция протекает преимущественно в том направлении, которое отвечает взаимодействию более сильного акцептора (окислителя) с более сильным донором (восстановителем).
Чем больше численное значение константы, тем полнее протекает реакция, тем в большей степени равновесие сдвинуто в правую сторону. Большое численное значение константы равновесия свидетельствует о том, что реакция практически нацело протекает в прямом направлении – до полного исчезновения исходных веществ (конечно, если они были взяты в стехиометрических количествах).
Чем больше разность между стандартными электродными потенциалами окислителя и восстановителя окислительно-восстановительной реакции и чем больше при этом переносится электронов, тем полнее эта реакция протекает в заданном направлении.
Приведите примеры использования окислительно-восстановительных реакций для растворения малорастворимых соединений.
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Пример:
CaCO3 + 2 HCl = CaCl2 + H2CO3
ионно-молекулярное уравнение: CaCO3 + 2 H+ = Ca2+ + H2CO3
Константа равновесия:
Кс = [ Ca2+] [ H2CO3] / [H+]2 = КCaCO /КH CO = 3.7 10-9 / 2.1 10-17 = 1.7 108 >> 1, равновесие смещено вправо – идет процесс растворения.
Назовите основные окислители и восстановители, используемые для разделения и обнаружения ионов. Напишите соответствующие полуреакции.
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
| Окислитель | Полуреакции | ||
| O2 кислород | 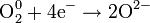
| ||
| ClO3− хлораты | |||
| HNO3 азотная кислота | |||
| H2SO4, конц. серная кислота | |||
| Шестивалентный хром | |||
| MnO2 оксид марганца(IV) | |||
| MnO4− перманганаты | |||
| Катионы металлов и H+ |
ВОССТАНОВИТЕЛИ, в-ва, отдающие электроны в окислит.-восстановит. р-циях. К сильным восстановителям принадлежат щелочные и щел.-зем. металлы, Al, Si, С, Н2 и ряд др. простых в-в, гидриды металлов и соед., содержащие неметаллы с отрицат. степенями окисления (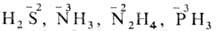 и др.)
и др.)
12. Почему избыток хлорид-ионов мешает обнаружению ионов марганца по реакции образования перманганата?
При малых концентрациях марганца определение рекомендуют проводить в 2 N H2S04, а при больших - в 3,5 N H2S04. Определению марганца мешают восстановители и хлорид-ионы. Допустимо присутствие 50-кратных количеств Cu(II), Ni(II) и 20-100- кратных количеств Со(II). Однако можно достигнуть полной компенсации окраски любых количеств этих примесей, применяя в качестве раствора сравнения испытуемый раствор, в котором Mn(VII) восстановлен до Mn(II) нитритом натрия. Такой способ дает хорошие результаты даже при количествах Сu, Ni, Со и Сг в 200-300 раз превышающих содержание марганца. Этот прием используют при определении содержания марганца в соединениях тория, сталях, манганиновых сплавах.
13. Почему не удается обнаружить ион марганца (II) действием окислителя на концентрированные растворы солей марганца (II) ?
розовая окраска не появится из-за неполного окисления Mn(II).
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:

Эта реакция используется для качественного определения Mn2+
Напишите реакции взаимодействия бромид- и иодид-ионов с хлорной водой и объясните, в какой последовательности они протекают.
AgNO3 + NaCI = AgCl + NaNO3, AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O, [Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3.Химическое равновесие в гетерогенных системах
Реакции происходящие на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и… В качестве типичного примера гетерогенной реакции рассмотрим лабораторный… Zn(тв) + H2SO4(р-р) = H2(г) + ZnSO4(р-р)Выведите формулу константы растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по… где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.Выведите формулу для расчета растворимости соединения АmВn.
Например

10. В каких случаях по величинам констант растворимости можно сравнивать растворимость малорастворимых соединений?
Считается, что малорастворимые соли могут переходить в раствор только в виде ионов. Поэтому в данной системе в равновесии находятся осадок и насыщенный раствор электролита:
KmAn (тв ) « mK++ nA–.
Применяя к этому уравнению закон действия масс и учитывая, что концентрация твердой фазы не входит в выражение константы равновесия, то константа равновесия Кр принимает вид:
Кр = [K+]m [A–]n.
Это уравнение показывает, что в насыщенном растворе трудно растворимого электролита произведение концентрации его ионов есть величина постоянная при данной температуре. Величина эта называется произведением растворимости (ПР):
Кр = ПР = [K+]m [A–]n.
Произведение растворимости как константа равновесия зависит от природы вещества и растворителя, от температуры и не зависит от концентрации ионов в растворе. ПР количественно характеризует растворимость вещества. Чем больше ПР, тем больше растворимость. Если:
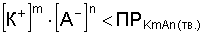 , то раствор ненасыщенный;
, то раствор ненасыщенный;
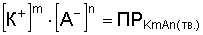 , раствор насыщенный;
, раствор насыщенный;
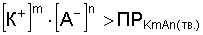 , раствор перенасыщенный.
, раствор перенасыщенный.
Сформулируйте условия образования и растворения осадка.
АаВв(т) АаВв(р). Константа равновесия этого процесса называется произведением растворимости… (44)Методы разделения и концентрирования
1. Дайте определение следующим понятиям: разделение, концентрирование, абсолютное и
Относительное концентрирование, коэффициент концентрирования.
Разделение смеси физическими или химическими методами возможно тогда, когда вещества (компоненты), их составляющие, обладают резко различными… КОНЦЕНТРИРОВАНИЕ-частный случай разделения компонентов исследуемой смеси, в… При индивидуальном концентрировании из образца выделяется один или последовательно неск. микрокомпонентов, а при…Осаждение и соосаждение как методы разделения и концентрирования.
СООСАЖДЕНИЕ, частичный переход компонента р-ра (расплава, пара), присутствующего в малых концентрациях (микрокомпонента), в твердую фазу, образуемую в данной системе др. компонентом, к-рый находится в значительно больших концентрациях. Важнейшая особенность соосаждения состоит в том, что находящийся в первоначально гомог. системе микрокомпонент не может в условиях проведения процесса (при понижении т-ры, удалении р-рителя, изменении рН и т. п.) образовать самостоят. твердую фазу, а вовлекается в твердую фазу вместе с макрокомпонентом.
В химическом анализе осаждение малорастворимых соединений применяют:
а) для разделения отдельных компонентов сложных смесей;
б) для обнаружения катионов и анионов;
в) для количественного определения составных частей индивидуального вещества или смеси веществ.
Осадители. В качестве осадителей для разделения и выделения отдельных компонентов анализируемых смесей применяют разнообразные химические соединения. Главнейшими из них являются: сероводород, осаждающий в виде сульфидов ионы V, IV и частично III аналитических групп.
При осаждении наблюдается очень интересное явление, заключающееся в том, что вместе с осаждаемым веществом в осадок выпадают некоторые соединения, относящиеся к группе хорошо растворимых веществ и сами по себе не осаждающиеся данным реактивом.
Однако это явление оказывает большую пользу там, где им пользуются для отделения и определения микроэлементов, содержащихся в ничтожно малых количествах в составе анализируемых природных или технических объектов.
Перечислите факторы, от которых зависит коэффициент распределения.
5. Какие из перечисленных параметров (концентрация, рН раствора, маскирующие вещества, температура) влияют на значение…Классификация экстракционных систем.
Экстра́кция— извлечения вещества , растворенного в одном растворителе , другим растворителем, который не смешивается с первым и лучше растворяет извлекаемое вещество.
Классификация по типу экстракционной системы:
"физическое" распределение и распределение, сопровождающееся химическими процессами (реакционная экстракция).
Классификация, основанная на природе экстрагентов: кислотные, основные и нейтральные экстрагенты. Классификация по типу экстрагируемого соединения: неионизированные соединения и ионные ассоциаты.
Назвать органические растворители, наиболее часто используемые в методах экстракции.
Для экстракции веществ в системе твердое тело — жидкость в качестве экстрагентов применяют органические растворители. Извлечение соответствующих веществ из твердых тел водой называется выщелачиванием.
Экстракция органическим растворителем (н-гексан,эфир)
Назвать основные типы соединений, в виде которых экстрагируются ионы металлов. Привести примеры.
Ионы железа (III) экстрагируют из солянокислого водного раствора эфиром . Ионы лития отделяют от других щелочных металлов экстрагированием ацетоном, в котором нерастворимы хлориды натрия, калия и др. Роданидные комплексы железа, кобальта, молибдена экстрагируются смесью изоами-лового спирта и эфира. Соединения некоторых металлов с органическими реагентами — купфероном, оксихинолином, дитизоном и др. — экстрагируются эфиром, хлороформом, четыреххлористым углеродом и т. д.
В качественном анализе экстракцию используют для разделения веществ и извлечения окрашенных в характерный цвет соединений.
Метод экстракции органическими растворителями отличается рядом преимуществ по сравнению с другими методами повышения концентрации:
1) можно извлечь определяемое вещество из очень разбавленного раствора, т. е. повышается чувствительность метода;
2) не происходит соосаждения и экстрагируемое вещество количественно выделяют в чистом виде;
3) оказывается возможным выделять и разделять вещества, которые трудно или невозможно разделить другими способами.
14. Каковы достоинства и недостатки методов экстракции?
Экстра́кция— извлечения вещества , растворенного в одном растворителе , другим растворителем, который не смешивается с первым и лучше растворяет извлекаемое вещество.
Достоинством этого способа является простота метода и оборудования. Недостатками же служат:
а) неполнота экстракции действующих веществ (менее 90%);
б) большая продолжительность процесса;
в) завышенное содержание балластных веществ в извлечениях (ВМС, пектины, слизи, белки и др.);
г) трудоемкость (двойное прессование, промывка шрота).
15. В чем сущность методов хроматографии?
Итак, хроматографией следует называть процесс, основанный на перемещении дискретной зоны вещества вдоль слоя сорбента в потоке подвижной фазы и связанный с многократным повторением сорбционных и десорбционных актов. Хроматографический процесс осуществляется при сорбционном распределении вещества между двумя фазами, одна из которых перемещается относительно другой.
Разделение смеси не вызывает особых трудностей, если ее компоненты находятся в различных фазах. Оно существенно осложняется, если компоненты смеси образуют одну фазу. В этом случае приходится изменять агрегатное состояние отдельных компонентов (например, добиться их выпадения в осадок), либо применять химические или физические методы разделения. В основе последних лежат кинетические явления или фазовые равновесия.
Применение хроматографического метода не ограничивается лишь разделением и анализом смеси веществ. В последнее время хроматография широко используется и как метод, научного исследования, например, для исследования свойств сложных систем, в частности растворов.
16. Как классифицируются методы хроматографии по агрегатному состоянию фаз; механизму процесса разделения; технике выполнения и по цели проведения?
По агрегатному состоянию фаз хроматографию разделяют на газовую и жидкостную. Газовая хроматография включает газожидкостную и газотвердофазную, жидкостная — жидкостно-жидкостную, жидкостно-твердофазную и жидкостно-гелевую.
По механизму взаимодействия сорбента и сорбата можно выделить несколько видов хроматографии: распределительная хроматографияоснована на различии в растворимости разделяемых веществ в неподвижной фазе (газожидкостная хроматография) или на различии в растворимости веществ в подвижной и неподвижной жидких фазах; ионообменная хроматография— на разной способности веществ к ионному обмену; адсорбционная хроматография— на различии в адсорбируемости веществ твердым сорбентом; эксклюзионная хроматография— на различии в размерах и формах молекул разделяемых веществ, аффинная хроматография —на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов.
По технике выполнения выделяют колоночнуюхроматографию, когда разделение проводится в специальных колонках, и плоскостнуюхроматографию, когда разделение проводится на специальной бумаге (бумажнаяхроматография) или в тонком слое сорбента (тонкослойнаяхроматография).
По цели хроматографирования выделяют аналитическуюхроматографию (качественный и количественный анализ); препаративнуюхроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную(производственную) хроматографию для автоматического управления процессом (при этом целевой продукт из колонки поступает в датчик). Хроматографию широко используют для исследования растворов, каталитических процессов, кинетики химических процессов и т. п.
18. Каковы области применения, достоинства и недостатки методов адсорбционной хроматографии?
Газовая хроматография находит широкое применение в медицине для определения содержания многочисленных лекарственных препаратов, определения уровня жирных кислот, холестерина, стероидов и т.д. в организме больного. Такие анализы дают чрезвычайно важную информацию о состоянии здоровья человека, ходе его болезни, эффективности использования тех или иных лекарств. .
Газовая хроматография успешно используется для определения содержания полициклических ароматических соединений, опасных для здоровья человека, в воде и в воздухе, уровня бензина в воздухе помещений автозаправочных станций, состава выхлопных газов автомобилей в воздухе и т.д.
Этот метод широко используется как один из основных методов контроля чистоты окружающей среды.
Положительным для газа-адсорбционного варианта является:
только в этом случае проявляется высокая разделительная способность при анализе смесей газов и паров низкокипящих веществ;
термическая стабильность адсорбента в широком интервале изменения температуры хроматографической колонки; более высокая скорость массообмена, чем в варианте газо-жидкостной хроматографии, что приводит к быстрому разделению смесей веществ;
возможность модифицирования поверхности адсорбента; достаточная механическая прочность адсорбентов; доступность адсорбентов.
К недостаткам метода следует отнести:
недостаточную геометрическую однородность поверхности адсорбентов;
недостаточное постоянство химического состава поверхности адсорбентов из-за наличия примесей;
повышенную адсорбционную активность адсорбентов; повышенную каталитическую активность адсорбентов; нелинейность изотермы адсорбции; недостаточно широкий выбор адсорбентов.
19. В чём сущность метода ионообменной хроматографии?
- разделение сложных смесей органических и неорганических веществ на отдельные компоненты ;
- разделение и выделение растительных и животных пигментов, изотопов, редкоземельных элементов и других веществ;
- очистка веществ от примесей;
- концентрирование веществ из сильно разбавленных растворов;
- определение молекулярной структуры некоторых соединений путем установления связи между сорбируемостью и строением данного вещества ;
- качественный и количественный анализ исследуемых веществ.
20. Назвать основные типы ионитов. Что называется обменной ёмкостью ионита?
Типы ионитов по природе ионогенных групп:
- катиониты;
- аниониты;
- амфолиты, селективные-комплексообразующие;
- по силе ионизации ионогенных групп:
- сильно диссоциирующие;
- средне диссоциирующие;
- слабо диссоциирующие;
- по материалу матрицы:
- полимеризационные (полистирольные, полиакриловые, поливинилпиридиновые);
- поликонденсационные (фенол-формальдегидные, полиэтиленполиаминные).
- по типу матрицы:
- гелевые;
- макропористые;
- волокна.
Все типы ионитов могут разделяться по назначению на:
- технические;
- пищевые;
- специальные.
Важнейшей количеств. характеристикой ионитов является обменная емкость - суммарное кол-во противоионов, приходящихся на единицу массы или объема ионита, в мг-экв/г(мл) или ммоль/г(мл).
Каковы области применения, достоинства и недостатки метода ионообменной хроматографии.
Достоинствами ионной хроматографии являются высокая селективность определения ионов, возможность одновременного определен я органических и… Невысокая стабильность ионогенных материалов является одним из недостатков…Пояснить сущность метода осадочной хроматографии. Назвать варианты этого метода анализа.
Осадочная хроматография — метод хроматографии, основанный на способности разделяемых веществ образовывать малорастворимые соединения с различными произведениями растворимости.
В основу той или иной классификации хроматографических методов могут быть положены различные характерные признаки процесса. При этом следует учитывать, что существуют промежуточные варианты, не укладывающиеся в рамки строгой классификации. Более того, именно такие промежуточные варианты часто оказываются весьма перспективными и даже единственно возможными для решения сложных задач анализа.
В зависимости от агрегатного состояния подвижной и неподвижной фаз "различают варианты газовой и жидкостной хроматографии.
Газовой хроматографией называют хроматографический процесс, в котором подвижной фазой является газ (или пар). Варианты газовой хроматографии -- газо-адсорбционная и газожидкостная хроматография, а также промежуточные методы.
В газо-адсорбционной (точнее -- газо-твердофазной) хроматографии неподвижной фазой служит твердый адсорбент, а подвижной-- газ.
В газожидкостной хроматографии неподвижной фазой служит жидкость, нанесенная на инертный носитель, а подвижной -- газ.
23. На чём основан качественный анализ методами осадочной и распределительной хроматографии на бумаге?
По механизму разделения различают распределительную, адсорбцион-ную, осадочную и другие виды бумажной хроматографии (БХ). В распре-делительной жидкость-жидкостной хроматографии бумага, приготовлен-ная из специальных сортов хлопка, выполняет роль носителя неподвижной жидкой фазы (НФ), в качестве которой часто выступает вода, адсорбиро-ванная парами бумаги. В таком случае гидрофильная бумага используется для нормально-фазовой хроматографии.
Растворителями (ПФ) являются спирты (метанол, этанол, н-пропанол, бутанол), простые эфиры (этиловый, метиловый), кетоны (ацетон, ацетил-ацетон), эфиры органических кислот (метилацетат, этилацетат), пиридин, хлороформ. Чаще используются смеси растворителей.
Для проведения хроматографии на бумаге используют стеклянные герметизированные камеры. Внутри ка-меры в верхней (нисходящий вариант) или нижней ее части (восходящий вариант) помещают сосуд для подвижной фазы (лодочку).
Радиальную хроматографию можно осуществить в чашке Петри. Детекцию зон, идентификацию и количественное определение в БХ проводят также, как и в методе тонкослойной хроматографии.
Методом распределительной жидкостной бумажной хроматографии успешно анализируют смеси катионов в неорганическом качественном анализе, смеси аминокислот и других органических кислот, пептидов, пес-тицидов, фенолов, красителей, синтетических поверхностно-активных ве-ществ.
24. Как количественно оценивают способность различных веществ к разделению на бумаге?
Тонкослойная хроматография (ТСХ).В ТСХ разделение компонентов осуществляется в тонком слое
сорбента, нанесенного на твердую плоскую подложку. Пластины для ТСХ можно изготавливать самостоятельно, либо использовать пластины заводского изготовления, имеющие достаточно широкий ассортимент как по типу сорбента и размерам его зерен, так и по материалу подложки (стекло, алюминиевая фольга или полимерная пленка). Для закрепления
сорбента применяют гипс, крахмал, силиказоль и др. вещества, которые способны удерживать зерна сорбента на подложке. Слой сорбента должен быть равномерным по толщине в любом месте хроматографической пластинки.
В основе разделения веществ методом ТСХ лежит различие в степени сорбции-десорбции разделяемых компонентов на неподвижной фазе (сорбенте). Адсорбция компонентов осуществляется за счет ван-дер- ваальсовых сил (физическая сорбция) или химического взаимодействия адсорбента и адсорбата (хемосорбция, ионный обмен). Разделение веществ
в ТСХ может осуществляться и по распределительному механизму, когда подвижная и неподвижная фазы - несмешивающиеся друг с другом жидкости. Различие в коэффициентах распределения компонентов между фазами приводит к разделению веществ.
28. В чем сущность тонкослойной хроматографии?
Тонкослойная хроматография (ТСХ) является планарной разновидностью жидкостной хроматографии, в которой подвижная фаза (ПФ) движется в пористой среде слоя адсорбента.
Процесс подобен бумажной хроматографии, но его преимуществом является большая скорость анализа, более высокое качество разделения, и возможность выбора одной из неподвижных фаз, обладающей наиболее подходящими свойствами. В настоящий момент тонкослойная хроматография (ТСХ)является одним из основных методов анализа смесей органических веществ в научных лабораториях и полностью вытеснил бумажную хроматографию.
Современная хроматографическая пластинка представляет собой основу из стекла, алюминия или полимера (например политерефталат). В связи с тем, что стеклянная основа становится менее популярной (часто бьется, нельзя разделить пластинку на несколько частей не повредив слой сорбента, тяжелая по весу), наибольшее распространение получили пластины, в качестве основ которых используют алюминиевую фольгу или полимеры.
Для закрепления сорбента применяют гипс, крахмал, силиказоль и др., которые удерживают зерна сорбента на подложке. Чем меньше диаметр зерен сорбента, тем качественнее (идентификаци дороже) пластинка. Толщина слоя может быть различна (100 и более мкм), но самый важный критерий - слой должен быть равномерный по толщине в любом месте хроматографической пластинки.
29. Каковы преимущества тонкослойной хроматографии перед другими хроматографическими методами?
Процесс подобен бумажной хроматографии, но его преимуществом является большая скорость анализа, более высокое качество разделения, и возможность выбора одной из неподвижных фаз, обладающей наиболее подходящими свойствами. В настоящий момент тонкослойная хроматография (ТСХ)является одним из основных методов анализа смесей органических веществ в научных лабораториях и полностью вытеснил бумажную хроматографию.
Равновесия комплексообразования и их роль в аналитической химии
Что такое комплексное соединение
Комплексные соединения (КС) – это продукт сочетания простых соединений, способных к самостоятельному существованию.
КС– это такие соединения, в узлах кристаллической решётки которых находятся комплексы или комплексные ионы, споСоставные части комплексных соединенийсобные к самостоятельному существованию
Какие факторы влияют на устойчивость комплексных соединений
Устойчивость комплекса определяется как фундаментальными факторами (природой комплексообразователя и лигандов), так и внешними условиями… Влияние внешних условии на устойчивость комплексов учитываетсяпри расчете… Среди фундаментальных факторов, влияющих на устойчивость комплексов, можно выделить природу центрального атома и…Назовите основные типы комплексных соединений. Приведите примеры.
Аммиакаты – комплексы, в которых лигандами * служат молекулы аммиака, например [Cu(NH3)4]SO4, [Co(NH3)6]Cl3.
Аквакомплексы – лигандами являются молекулы воды: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3.
Ацидокомплексы – лигандами являются анионы. Ацидокомплексы можно представить как продукты сочетания двух солей. Например: PtCl4·2KCl или K2[PtCl6], Fe(CN)2·4KCN или K4[Fe(CN)6] (желтая кровяная соль), Fe(CN)3·3KCN или K3[Fe(CN)6] (красная кровяная соль).
5. Дайте определение следующим понятиям: комплексообразователь, лиганды, координационное число, дентатность лиганда, заряд комплексного иона.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Лиганды (Адденты) — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
Координационное число (в химии и кристаллографии) — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле.
Дентатность -Число занимаемых лигандом координационных мест центрального атома (или атомов), называется дентатностью
Заряд комплексного иона равен сумме зарядов комплексообразователя и лигандов.
6. Что называется внутрикомплексным соединением? Приведите примеры
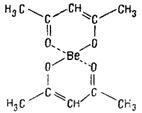
Внутрикомплексные соединения (хелаты) — образуются, при взаимодействии ионов металлов с молекулами некоторых органических веществ. В молекулах Внутрикомплексных соединений имеется шестичленный или пятичленный цикл. Напр., внутрикомплексное соединение Be (П) с ацетил ацетоном (в енольной форме) СН3—СO—СН=С(OH)—СН3 имеет следующее строение:
7. Какие равновесия имеют место в растворах комплексных соединений? Как можно охарактеризовать эти равновесия?
В растворах комплексных соединений существует система динамических равновесий, зависящая от характера растворенного вещества и природы растворителя.
Растворам комплексных соединений, относящихся к электролитам, свойственны динамические ионные равновесия, характерные для электролитов. Иначе говоря, комплексные соединения в растворах подвержены в значительной степени первичной электролитической диссоциации. Не изменяющиеся в концентрированном растворе комплексные соли при разбавлении ведут себя так же, как и простые соли, т. е. распадаются на ионы. Это подтверждается изменением электропроводности растворов комплексных соединений.
8.Что такое ступенчатые и общие константы устойчивости комплексных соединений?
Устойчивые комплексные ионы значительно различаются по относительной способности диссоциировать на составные части. Диссоциация достаточно устойчивых комплексных ионов, как и диссоциация слабых электролитов, может быть количественно охарактеризована константами равновесий, которые называются в этом случае ступенчатыми константами нестойкости.
Равновесие, устанавливающееся при реакциях комплексообразования между гидратнроианными ( свободными) ионами металлов, аддендом реагента или между аддендом и комплексом в растворе, характеризуется константо / i равновесия, называемой общей константой устойчивости комплексного соединения. Обратное значение этой константы соответствует диссоциации комплекса и называется константой нестойкости комплекса.
Дайте теоретическое обоснование возможности использования комплексных соединений для избирательного растворения и осаждения малорастворимых соединений.
Использование комплексных соединений для осаждения малорастворимых осадков. Ряд комплексных солей, образованных катионами тяжелых металлов и анионами комплексных кислот, малорастворимы в воде. Например, многие катионы тяжелых металлов образуют с гексацианокобальтатом (III) ярко окрашенные, малорастворимые соли, например: Ni3[Co(CN)6]2 — зеленый, Co3[Ce(CN6J2 — розовато-красный и др.
Многие комплексные ионы отличаются высокой устойчивостью. Кроме того, большое число комплексных соединений имеет характерную окраску. Эти свойства комплексных соединений широко используют в качественном и количественном анализе. Например, ряд катионов обнаруживают путем образования комплексных соединений. Так, открывают ионы: K+(Ks[Co(NOg)6] —желтый осадок), Fe+++ (Fe4IFe (CN) 6]з~ синий), Fe++(Fe3[Fe(CN)6]2 — синий), Cu++([Cu(NH3)4](OH)2-синий и Cu2[Fe(CN)6] —красный) и др.
Использование комплексообразования для маскировки ионов. Во многих случаях метод комплексообразования применяют для маскировки мешающих ходу анализа ионов. Например, если по ходу анализа ионы железа (III) мешают обнаружению других ионов, то Fe++* маскируют добавлением в анализируемый раствор фосфорной кислоты, фторида аммония, оксалата или тартрата натрия, с которыми Fe+++ образует бесцветные прочные комплексные ионы: [Fe (PO4) 2]"""", [FeFe]""", [Fe(C2OzO3]—, [Fe(C4H4Oe)3]"-""". При этом образуются настолько прочные комплексные анионы, что даже чувствительные реактивы на Fe+44" (как, например, роданид аммония) не
10.Какие свойства комплексных соединений имеют наиболее важное значение для обнаружения и разделения ионов?
Сопоставляя свойства кислородсодержащих кислот и их анионов, можно видеть сходство свойств элементов по диагональным направлениям таблицы Менделеева.
Деление анионов на группы определяется: 1) закономерностью в осаждении их групповыми реагентами (например, нитратом серебра, нитратом бария) и растворимостью полученных солей в кислотах (уксусной, азотной); 2) их окислительно-восстановительными свойствами;
Применение редокс-индикатора должно зависеть не от специфических свойств окислителя или восстановителя, но только от окислительных потенциалов титруемой системы и индикатора.
Окислительно-восстановительные свойства антраниловой кислоты ярко выявляются при ее реакции с солями церия (IV), например с Ce(SO4)2 ).
Пермангана-тометрическое определение перекиси водорода основано на реакции, в которой Н2О2 проявляет свойство восстановителя:
Первый тип реакций показывает, что растворители, распадаясь при взаимодействии их молекул на катион и анион, проявляют амфотерные свойства; например, вода дает ионы гидроксония и гидроксила.
Некоторые свойства растворителей, применяемых в неводном титровании, экстрационном и хроматографическом анализе
Классификация растворителей вытекает из свойств водородных соединений: метан — инертный растворитель (и все углеводороды), аммиак — основной, вода — амфотерный, фтороводород — кислый.
В каждом растворителе кислотными свойствами обладают те соединения, которые имеют общий катион с растворителем, а основаниями— соединения, имеющие общий анион с растворителем.
11. Приведите примеры использования реакций комплексообразования для растворения:
А) сульфатов бария и свинца; б) хлоридов серебра и ртути (I).
Методы комплексообразования основаны на использовании реакций комплексообразования, например: Ag+ + 2CN- = [Ag(CN)2]- – цианометрия; Al3+ + 6F- = [AlF6]3- – фторометрия.Приведите примеры использования реакций комплексообразования для маскирования мешающих ионов.
Реакции комплексообразования.
Ступенчатое комплексообразование. Количественные характеристики комплексных соединений: константы устойчивости (ступенчатые и общие), степень… Влияние комплексообразования на растворимость соединений, кислотно-основное…Приведите примеры использования реакций комплексообразования для идентификации ионов.
Химическая идентификация (обнаружение) - это установление вида и состояния фаз, молекул, атомов, ионов вещества на основе сопоставления экспериментальных и справочных данных для известных веществ. При идентификации определяется комплекс свойств вещества: цвет, фазовое состояние, плотность, вязкость, температура кипения, плавления, растворимость и др.
Имеются некоторые реакции, которые позволяют обнаружить то или иное вещество или ион в присутствии других веществ или ионов. Такие реакции называются специфическими. Например, ион NН4+ обнаруживается реакцией NH4Cl + NaOH = NH3↑ + H2O + NaCl, а йод с крахмалом дает синее окрашивание.
Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения или изменение цвета раствора.
Имеется много органических и неорганических реагентов, образующих осадки или окрашенные комплексные соединения с катионами и анионами.
Например, ализарин + Al3+ → ярко-красный осадок,
дихромат калия К2Cr2O7 + Ca2+ → оранжевый осадок,
дифениламин (С6Н5)2NH + NO3- → раствор темно-синего цвета.
Таким образом, химическая идентификация заключается в основном на реакциях осаждения, комплексообразования.
– Конец работы –
Используемые теги: основные, понятия0.048
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основные понятия
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов