Сформулируйте условия образования и растворения осадка.
Равновесие, устанавливающееся между осадком малорастворимого вещества и его насыщенным раствором описывается уравнением:
АаВв(т)  АаВв(р)
АаВв(р)
 .
.
Константа равновесия этого процесса называется произведением растворимости малорастворимого соединения
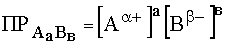 (44)
(44)
и при постоянной температуре является величиной постоянной.
Условие образования осадков непосредственно вытекает из выражения (44): если в растворе произведение реальных концентраций ионов  и
и  , рассчитанное по формуле (44), больше, чем произведение растворимости
, рассчитанное по формуле (44), больше, чем произведение растворимости  при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.
при данной температуре, то осадок выпадает. Если же произведение меньше численного значения произведения растворимости, то осаждения не происходит.
Если возникает необходимость растворить осадок  , то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения
, то следует уменьшать в его насыщенном растворе концентрации соответствующих ионов за счет вовлечения их в различные комплексы, либо путем изменения кислотности среды, либо, наконец, сочетая исходное равновесие (43) с окислительно-восстановительными взаимодействиями. Во всех перечисленных случаях в процесс «осаждение растворение» включаются донорно-акцепторные равновесия, которые могут существенно изменить растворимость соединения  .
.
12. Как влияет температура на растворимость осадка?
Изменение растворимости в зависимости от температуры связано с тепловым эффектом растворения. Растворение большинства солей сопровождается охлаждением раствора, т. е. поглощением тепла. Растворимость таких солей согласно принципу Ле-Ша-телье должна возрастать при повышении температуры. Наоборот,, когда при растворении происходит выделение тепла, растворимость с повышением температуры уменьшается.
Если при повышении температуры происходит превращение одного кристаллогидрата в другой, т. е. изменяется кристаллическая решетка соли, то может случиться, что разные кристаллогидраты будут различно реагировать на повышение температуры, и, следовательно, изменится растворимость.
Однако растворимость многих осадков, например таких, которые содержат анионы некоторых органических кислот (диметил-глиоксимат никеля, оксихинолинат алюминия и др.), в органических растворителях гораздо выше, чем в воде. Поэтому в количественном анализе всегда следует учитывать влияние на растворимость осадков температуры и природы растворителя.
13. Каковы причины растворимости малорастворимых соединений: а) в кислотах; б) в щелочах?
РАСТВОРИМОСТЬ, способность в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением компонентов. Обычно растворителем считают в-во, к-рое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся р-р. Если до растворения оба в-ва находились в одном и том же агрегатном состоянии, р-рителем считается в-во, присутствующее в смеси в существенно большем кол-ве.
Влияние кислот на растворимость малорастворимых солей различно. Например, малые количества соляной кислоты сильно уменьшают ( согласно закону действия масс) растворимость хлорида серебра. Прибавление сильной кислоты к раствору малорастворимой соли сильной кислоты также увеличивает растворимость, так как кислоты можно рассматривать как соли гидроксония. В случае прибавления сильной кислоты к раствору малорастворимой соли слабой кислоты, например при добавлении НС1 к насыщенному раствору CaF2, находящемуся в равновесии со своим осадком, последний частично растворяется.
Малорастворимые основания легко растворяются в минеральных кислотах, но не растворяются в солях аммония. Малорастворимые кислоты типа Н2SiO3 не растворимые в воде и минеральных кислотах, легко растворяются в 2н. растворе гидроксида натрия образованием растворимых солей.
Малорастворимые соли сильных кислот, например сульфаты щелочноземельных металлов и свинца ( BaSO4, SrSO4, PbSO4), га-логениды серебра ( AgCl, AgBr, Agl) и др., нерастворимые в минеральных кислотах и щелочах, приходится переводить в другие соединения.
16. Как перевести сульфаты катионов II группы в карбонаты?
Растворимость сульфатов бария, стронция и кальция в воде незначительна. количества сульфата бария достаточно, чтобы при добавлении концентрированного раствора Na2CO3 из насыщенного раствора сульфата бария выпал осадок.
BaCO3. При этом понижается концентрация Ва++, находящегося в растворе. Вследствие нарушения состояния динамического равновесия, устанавливающегося в насыщенном растворе между осадком и раствором соли, растворяется новая часть осадка BaSO4, которая под влиянием Na2CO3 снова переходит в BaCO3.
Вследствие указанных процессов при кипячении нерастворимых в воде сульфатов с концентрированным раствором Na2CO3 происходит обменное разложение между растворенной частью сульфатов и Na2CO3 по схеме:
Na2CO3 v
BaSO4 ^=± Ba++ + SO~ < > BaCO3 + 2Na+ + SO4" осадок раствор осадок раствор
Сопоставляя величины произведений растворимости сульфата и карбоната бария, мы видим, что BaSO4 является наименее растворимым соединением. Поэтому перевод BaSO4 в BaCO3 требует многократной обработки осадка BaSO4 концентрированным раствором Na2CO3.
превращение BaSO4 в BaCO3 будет наблюдаться в том случае, если концентрация CO3" превысит концентрацию SO4" более чем в 50 раз, именно вследствие этого применяют концентрированный раствор Na2CO3.
Реакция обратима и, следовательно, не дойдет до конца при однократной обработке осадка сульфата бария. По мере протекания реакции концентрация CO3"" уменьшается, а концентрация SO4"" увеличивается, и в конце концов соотношение этих концентраций достигает 50; тогда устанавливается равновесие, т. е. превращение BaSO4 в BaCO3 приостанавливается.