ОВР включают два процесса две полуреакции: окисление и восстановление
ОКИС ЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называют окислительно-восстановительными (ОВР).
ОВР включают два процесса (две полуреакции): окисление и восстановление.
Окисление — это процесс отдачи электронов атомом или ионом, например:
Zn° - 2е = Zn+2,
Восстановление — это процесс присоединения электронов атомом или ионом, например:
S0 + 2е = S'2,
Окислитель — атом или ион, принимающий электроны.
Восстановитель — атом или ион, отдающий электроны.
| Окислитель | Восстановитель |
| + пе | - пе |
| понижает степень окисления | повышает степень окисления |
| Восстанавливается | Окисляется |
Различают следующие типы ОВР:
1) межмолекулярные реакции, в которых окислитель и восстановитель находятся в составе разных молекул
0 +2 0 +2
Fe + CuSO4 = Cu + FeSO4
+7 +2 0
2КМпО4 + 16HCI = 2MnCI2 + 2КCI + 5 CI2 +8Н2О
2) внутримолекулярные реакции, в которых окислитель и восстановитель находятся в составе - одной молекулы
+7 +6 +4
2KMnO4 =К2 MnO4 +MnO2+ О2°
+5 -2 -1
2КСlO3 =2КС1 - + ЗО20
3) реакции диспропорционирования, в которых атомы одного элемента одновременно повышают и понижают степень окисления
-1 +1
С1° + Н2О = HCI + НСlO
-2 +4
3S0 + 6NaOH = 2Na2 S + Na2SO3 + ЗH2О.
Алгоритм
Определения продуктов реакции и нахождения стехиометрических коэффициентов
1) Определяют окислитель и восстановитель. При этом удобно пользоваться списком типичных окислителей и восстановителей. Важнейшие окислители: электрический ток на аноде,Окислительно-восстановительная двойственность
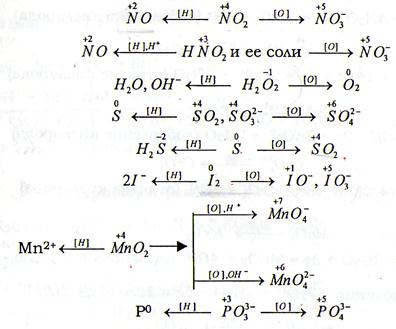 Атомы, проявляющие в соединениях промежуточную степень окисления, являются или окислителями, или восстановителями в зависимости от характера второго реагента, т.е. этим соединениям присуща окислительно-восстановительная двойственность.
Атомы, проявляющие в соединениях промежуточную степень окисления, являются или окислителями, или восстановителями в зависимости от характера второго реагента, т.е. этим соединениям присуща окислительно-восстановительная двойственность.