Белки, их структура и функции
Таким образом, белки – это конечные продукты экспрессии генов. Основной класс белков – это ферменты (энзимы), которые служат биологическими катализаторами, обеспечивающими высокую скорость и точность всех биохимических реакций в организме. Ферменты осуществляют как синтез (анаболизм), так и расщепление (катаболизм) всех органических молекул в клетке, включая углеводы, липиды, белки и нуклеиновые кислоты.
Белки выполняют также огромное количество других функций. Так структурные функции осуществляют – коллаген (хрящи, сухожилия), кератин (перья, волосы, когти, рога); транспортные – гемоглобин(перенос О2 и СО2), альбумин (жирные кислоты), глобулины (гормоны металлы); сократительные – актин, миозин (работа мышц), тубулин (веретено деления, реснички); гормональные – инсулин (регулирует содержание глюкозы).
Белки – это полимеры мономерами, которых являются аминокислоты. В состав природных белков входит только 20 аминокислот. Аминогруппа одной аминокислоты способна взаимодействовать с карбоксильной группой другой аминокислоты с образованием пептидной связи (–СО–NH–) и выделением молекулы воды. При этом образуется дипептид:
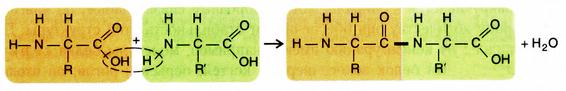
Если таким образом соединяется несколько аминокислот (более 10), то образуется – полипептид. Полипептиды в молекулы, которых входит более 50 аминокислотных остатков называются белками.
Белковые молекулы имеют четыре уровня (структуры) пространственной организации. Первичная структура молекулы белка представляет собой цепочку из аминокислот соединенных пептидными связями (рис. 13,а). Это наиболее важная структура, поскольку она 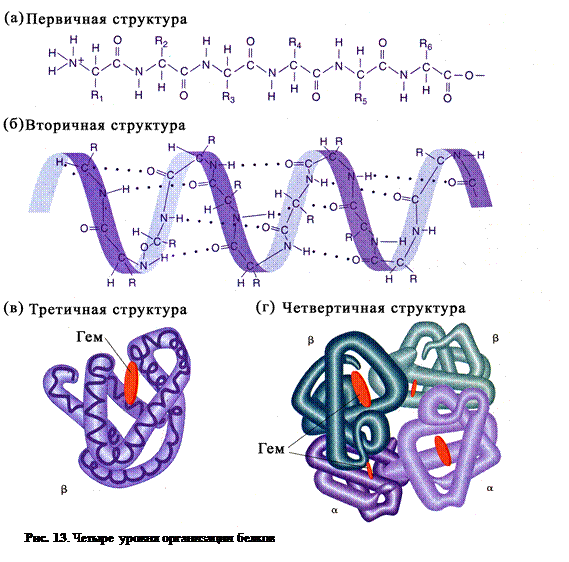
определяет форму и свойства белка. Каждый белок организма имеет уникальную первичную структуру. Вторичная структурабелковой молекулы возникает в результате образования водородных связей между атомом водорода NH-группы и СО-группы разных аминокислотных остатков полипептидной цепи (рис. 13,б). Полипептид при этом закручивается в спираль. Такая структура характерна для кератина, коллагена, инсулина, миозина, фибриногена и др.Третичная структура создается S–S связями (дисульфидным мостиками), а также гидрофобно-гидрофильными взаимодействиями разных частей молекулы полипептида (рис. 13,в). Третичной структурой определяется специфичность белковых молекул, их биологическая активность. Некоторые белки имеют четвертичную структуру.В этом случае несколько полипептидных цепей с третичной структурой за счет межмолекулярных взаимодействий объединяются в единый комплекс. Ярким примером белка с четвертичной структурой является гемоглобин,состоящий из четырех полипептидных субъединиц и небелковой части – гемма (рис. 13,г).