ОДЕРЖАННЯ ПОРОШКІВ МЕТАЛІВ ТА СПЛАВІВ ВІДНОВЛЕННЯМ ЇХ ОКСИДІВ ТА СОЛЕЙ
При виробництві металевих порошків широко застосовуються методи відновлення їх оксидів та солей воднем, вуглецем або іншими більш активними металами.
У загальному виді реакцію відновлення оксиду воднем можна представити у виді рівняння:
МеО+ Н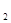 =Ме + Н
=Ме + Н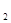 О
О
Реакція йде убік відновлення, якщо при даній температурі і тиску вивільняється вільна енергія, тобто зміна ізобарно-ізотермічного потенціалу ( ) має негативний розмір. Для цієї реакції константа рівноваги (
) має негативний розмір. Для цієї реакції константа рівноваги ( 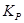 ) зв'язана зі зміною ізобарно-ізотермічного потенціалу рівнянням:
) зв'язана зі зміною ізобарно-ізотермічного потенціалу рівнянням:
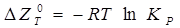
або, якщо реагенти не знаходяться в заданому стані,
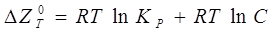
де С - відношення добутків концентрацій продуктів реакції і вихідних реагентів у заданому стані.
При участі в реакції газоподібних речовин швидкість і напрямок реакцій також визначається відношенням парциальних тисків газоподібних реагентів, що рівні константі рівноваги реакції:
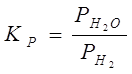
Чим вище значення 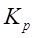 , тим при меншому вмісті водню в газовій суміші буде відбуватися процес відновлення. Зі значень константи рівноваги реакцій також випливає, що рівновага реакції зрушиться убік утворення металу за умови безупинного видалення пару води з реакційного простору і такою ж безупинною подачою водню.
, тим при меншому вмісті водню в газовій суміші буде відбуватися процес відновлення. Зі значень константи рівноваги реакцій також випливає, що рівновага реакції зрушиться убік утворення металу за умови безупинного видалення пару води з реакційного простору і такою ж безупинною подачою водню.
При нерівності числа молекул, що беруть участь у реакції - газу відновника і газу- продукту реакції , наприклад:
FeCl + H
+ H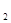
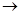 Fe + 2HCl
Fe + 2HCl
рівновага змінюється також із зміною загального тиску в системі. Підвищення тиску зрушує реакції убік зменшення загального об'єму газових реагентів.
Залежність константи рівноваги від температури виражається наближеним рівнянням

де  - зміна теплоємкості при стандартних умовах.
- зміна теплоємкості при стандартних умовах.
При одержанні металевих порошків відновленням, важливий вплив на кинетику процесів мають поверхневі явища в зв'язку з великою площею поверхні вихідних з'єднань і порошків, що утворяться. До таких явищ варто віднести адсорбцію, хемосорбцию, хімічні взаємодії в адсорбованих шарах, каталітична дія розвинутих поверхонь, десорбцию газоподібних продуктів реакції, дифузійні процеси.
Сучасні уявлення про механізм відновлення оксидів металів газоподібним відновником грунтуються на адсорбційно-автокаталітичній теорії.
Експериментальна частина
Мета роботи - дослідження умови одержання порошку міді відновленням її оксиду воднем. Встановлення впливу температури і часу відновлення на вихід металу і його властивості.
Матеріали і устаткування
1. Оксид міді -100 м.; 2. Балон із воднем -1 шт.; 3. Пічь для відновлення -1 шт.; 4. Нікелевий човник -1 шт. 5. Ваги для зважування (технічні) -1 шт.
Порядок виконання роботи
Наважку порошку оксиду міді потрібно помістити в нікелевий човник і розрівняти рівним шаром товщиною 5...8 мм. Човник установити у контейнер, після чого його закрити, помістити в муфель піч і пропустити водень.
Після заповнення муфеля воднем (через 5...6 хв.) його підпалюють на виході. При впуску водню необхідно дотримувати необхідні запобіжні заходи.
Відновлення вести при режимах зазначених викладачем. Отриманий порошок міді потрібно зважити.
Зробити розрахунок повноти відновлення по реакції:
CuO + H2 = Cu + H2O
З 63,54 + 16 г (грам моль Сu) утвориться 63,54 г /грам-атом/ міді. Отже з 100 г (наважки Сu) повинні одержати x г міді (теоретичний вихід)
Відношення маси отриманого порошку міді до теоретичної дасть практичний вихід металу.
Обговорення результатів
Отримані результати пояснити з погляду фізико-хімічних процесів, що відбуваються при відновленні оксидів металів газоподібним відновлювачем.
Зробити висновки про виконану роботу.
Запобіжні заходи
1.Починати роботу можна тільки в присутності викладача або навчального майстра при дотриманні правил роботи з воднем згідно з інструкцією