Методичні вказівки
до лабораторних робіт
для студентів хімічних спеціальностей
Затверджено
на засіданні кафедри
аналітичної хімії
Протокол № 3 від 29 жовтня 2010 р.
Львів – 2010
Титриметричний аналіз: Методичні вказівки до лабораторних робіт для студентів хімічних спеціальностей. /Укл. П.Й. Шаповал, М.М. Ларук, Й.Й. Ятчишин, Д.І. Семенишин, Г.О. Маршалок, І.П. Полюжин, О.Я. Борова, Ф.І. Цюпко - Львів: Видавництво Національного університету "Львівська політехніка", 2010. - 24 с.
Укладачі: Шаповал П.Й., канд. хім. наук, доц.
Ларук М.М., канд. техн. наук, доц.
Ятчишин Й.Й., д-р.хім.наук, проф.
Семенишин Д.І., д-р.хім.наук, проф.
Маршалок Г.О., д-р.техн.наук, проф.
Полюжин І.П., канд. техн. наук, доц.
Борова О.Я., канд. хім. наук, доц.
Цюпко Ф.І., канд. хім. наук, доц.
Відповідальний за випуск: Ятчишин Й.Й., д-р.хім.наук, професор
Рецензенти: Старчевський В.Л., д-р.техн.наук, професор
Титриметричний (об’ємний) аналiз - метод кількісного хімічного аналізу, який грунтується на точному вимiрюваннi об’єму реагенту (титранта), витраченого на реакцiю з визначуваною речовиною. Розрахунок результатів титриметричного аналізу базується на принципі еквівалентності [1, с. 43].
Титрування - приливання краплями титранта до аналiзованого розчину за допомогою бюретки до точки еквiвалентності. Точкою еквівалентності називається момент титрування, коли кiлькiсть долитого титранту еквiвалентна кiлькостi аналізованої речовини.
Стандартним розчином або титрантом називають розчин реагенту з точно відомою концентрацією. Встановлення точної концентрації титранту з відносною похибкою, не більшою ніж 0,1 %, називають стандартизацією.
Концентрація розчинів —величина, що вимірюється масою або кількістю розчиненої речовини, яка міститься у певній масі або об’ємі розчину чи розчинника. Широко вживаними є такі способи вираження концентрації: масова частка, молярна концентрація, молярна концентрація еквівалента (нормальна концентрація), титр.
Масова частка ω(А) показує масу розчиненої речовини А (г) у 100 г розчину. Її виражають у частках від одиниці або у відсотках (%).
Молярна концентрація С(А) – кількість моль розчиненої речовини в 1 дм3 розчину. Якщо кількість розчиненої речовини n(А) визначають за вмістом еквівалентів цієї речовини у розчині, то використовують поняття молярної концентрації еквівалента (нормальної концентрації).
Оскільки молярну концентрацію речовини А та молярну концентрацію еквівалента цієї речовини позначають одним і тим самим символом С, то після нього необхідно вказати у дужках, яка величина узята за моль. Наприклад, якщо позначають молярну концентрацію KMnO4, то її записують С(KMnO4). Якщо ж йдеться про молярну концентрацію еквівалента KMnO4, коли 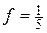 , то її позначають
, то її позначають 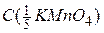 . Одиницями вимірювання молярної концентрації є [моль/дм3] , [моль/л] чи скорочено [М]. Наприклад,
. Одиницями вимірювання молярної концентрації є [моль/дм3] , [моль/л] чи скорочено [М]. Наприклад,
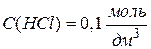 або
або 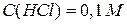 ;
;
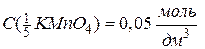 або
або 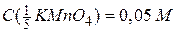 .
.
Нормальну концентрацію інколи позначають у моль-екв/дм3 або скорочено літерами н чи N. Наприклад,
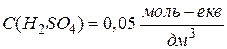 або
або 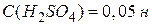 або
або 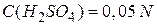 .
.
Титр – це також спосіб вираження концентрації, який показує скільки грамів розчиненої речовини є в 1 см3 розчину [г/см3].
Формули переходу від одного вираження концентрації до іншого наведено у [2, с. 3].