Дихроматометричне титрування
Стандартний розчин K2Cr2O7 готують за точною наважкою хімічно чистої сухої солі або з фіксаналу. При титруванні калій дихроматом різних відновників відбувається відновлення хрому (VI) до хрому (III):
 ;
;
 .
.
Титрування калій дихроматом ведуть у сильно кислому середовищі. Солі хрому (III), які утворюються в результаті реакції, забарвлюють розчин у зелений колір, тому розчин перед титруванням необхідно розбавити. Для фіксування точки еквівалентності використовують окисно-відновний індикатор, переважно дифеніламін або фенілантранілову кислоту [1, с. 80].
Лабораторна робота № 7
дихроматометричне Визначення ФЕРУМУ (ІІ)
Визначення феруму (ІІ) описується рівнянням реакції:
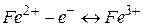
| 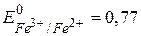 В; В;
| |

|  В. В.
|

При використанні дифеніламіну як індикатора, титрування проводять у присутності фосфатної кислоти, яка утворює з йонами Fe3+ безбарвну комплексну сполуку:
 .
.
Утворення такого комплексу зменшує концентрацію іонів Fe3+ і, відповідно, знижується значення окисно-відновного потенціалу пари Fe3+/Fe2+. Межі стрибка титрування розширюються вiд 0,76 В до 1,30 В і показник титрування дифеніламіну (рТ = 0,76 В) потрапляє у межі стрибка [1]. Це забезпечує необхідну точність фіксування точки еквівалентності, бо дифеніламін змінює своє забарвлення в межах стрибка титрування.
Методика визначення.Масу наважки проби, яку необхідно взяти для аналізу, розраховують за формулою:
 [г].
[г].
Для розрахунку використовують такі значення: ω(Fe) ~ 10 %;  M;
M;  см3;
см3;  ;
;  г/моль.
г/моль.
Беруть наважку аналізованої проби, близьку до розрахованої, висипають у колбу для титрування місткістю 500-700 см3 і розчиняють у 20 см3 H2SO4 (1:4).
Після повного розчинення приливають 10 см3 Н3РО4 (ω(Н3РО4) = 30 %), 200-250 см3 дистильованої води і 1-2 краплі розчину дифеніламіну.
Титрують розчином калій дихромату до появи переходу світло-зеленого забарвлення у стійке синьо-фіолетове (при наближенні до точки еквівалентності титрують повільніше, старанно перемішуючи розчин).
Розраховують масову частку феруму в пробі за формулою:
 [%].
[%].