Визначення натрій карбонату в розчині
Кількісне визначення натрій карбонату за допомогою стандартизованого розчину хлоридної або сульфатної кислоти основане на реакції:
 або
або
 ;
;
 .
.
Вибір індикатора. З рівняння реакції видно, що у точці еквівалентності в реакційній суміші знаходиться натрій хлорид і слабка карбонатна кислота, яка зумовлює слабо кислу реакцію розчину (K1(H2CO3)= 4,5·10-7; pK1(H2CO3)=6,35).
При кімнатній температурі максимальна розчинність C(H2CO3)= 5·10-2 М.
Значення рН розчину в точці еквівалентності розраховують за формулою для слабких кислот:
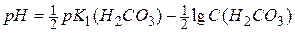 ;
;
 .
.
Кінцеву точку тирування фіксують за допомогою індикатора метилового оранжевого ( рТ = 4,0), який найкраще відповідає умові рТ = РНт.е. ± 0,5.
Методика визначення. Заповнюють бюретку стандартним розчином кислоти. У конічну колбу з аналізованим розчином натрій карбонату додають 1-2 краплі метилового оранжевого і титрують кислотою до переходу жовтого забарвлення розчину в оранжеве. Записують об'єм кислоти, який витрачено на титрування, і розраховують масу натрій карбонату за формулою:
 , [мг].
, [мг].
 ;
;  г/моль.
г/моль.
Лабораторна робота № 4