рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Педагогика
- /
- Методы управления свойствами материала.
Реферат Курсовая Конспект
Методы управления свойствами материала.
Методы управления свойствами материала. - раздел Педагогика, Лекция 1 Предмет изучения материаловедения Управляя Концентрацией Точечных Дефектов Можно Управлять Структурно Чувствите...
Управляя концентрацией точечных дефектов можно управлять структурно чувствительными свойствами маитериалов. Существует 4 основных способа управления концентрацией дефектов:
1. радиационная обработка материала
2. закалка мат-ла с более высокой температуры, при которой концентрация дефектов более высокая
3. механическое воздействие на материал
4. введение примесных атомов в узлы или междоузлия (легирование)
Управление по второму способу обычно осуществляют в 2 этапа. На первом проводят закалку. При этом концентрация дефектов трудновоспроизводима. На втором этапе проводят отжиг материала при не очень высокой температуре, контролируя одновременно какое-либо структурно чувствительное свойство (твердость, электросопротивление).
Линейные дефекты.
К линейным дефектам кристаллической структуры относят упорядоченные цепочки вакансий, междоузельных атомов, а также дислокации. Дислокация образуется, если кристалл разрезать полуплоскостью и половинки разреза сдвинуть определенным образом. В идеальном случае существует 2 типа дислокаций: краевая и винтовая (рис 9 а и б).
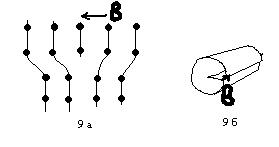
9 а) По плоскости разреза убрана одна кристаллографическая плоскость и оставшиеся половинки соединены.
9 б) По плоскости разреза половинки сдвинуты вдоль линии разреза.
Дислокация характеризуется так называемым вектором Бюргерса.
Если вокруг точки кристалла совершить круговой обход, а затем такой же обход совершить вокруг точки, содержащей дислокацию, то вектор, замыкающий путь и называется вектором Бюргерса b.
В реальных кристаллах дислокации имеют элементы и краевой и винтовой дислокации, поэтому их форма может быть весьма разнообразной. Если к кристаллу, содержащему дислокации, приложить внешнюю силу, то дислокация начнет перемещаться, как показано на рисунке 11.
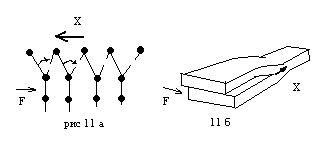
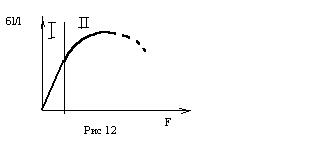
Краевая дислокация перемещается навстречу приложенной силе, при этом усилия деформации существенно меньше, чем для бездислокационного кристалла. Винтовая дислокация перемещается перпендикулярно приложенной силе. Реальные дислокации, имеющие признаки винтовой и краевой дислокации перемещаются под некоторым углом по направлению к силе. Когда дислокации «сталкиваются» они теряют способность к перемещению, в результате чего материал упрочняется. На рис 12 приведена типичная деформационная кривая, имеющая область упругой деформации 1 и область деформационного упрочнения 2.
Структура границ зерен кристалла.
Границы зерен относятся к дефектам поверхностного типа. Границы зерен можно рассматривать как скопление дислокаций на некоторой плоскости. Так как в области границы зерна, кристаллическая решетка сильно искажена то они могут стать плоскостью с повышенным содержанием примесей материала. Механическая и термическая обработка для придания материалу требуемых свойств может привести к эффекту повышения концентраций примесей по границам зерен. Это явление называется сегрегацией примесей по границам зерен. В свою очередь сегрегация может привести к повышенной хрупкости материала.
Лекция 4. Межатомная связь в кристаллах.
В твердых телах кристаллических и аморфных связь между атомами осуществляется за счет сил электростатического притяжения (кулоновского или дипольного), а также сил отталкивания, имеющих квантово-механическую природу. При сближении атомов, их электронные оболочки начинают перекрываться и одноименные электроны, занимающие одинаковые энергетические уровни в соответствии с принципом Паули начинают «расходиться» по разным энергетическим уровням, т.е. энергия системы повышается по мере сближения атомов, а это равносильно возникновению сил отталкивания.
В м-ведении из-за сложности точного расчета сил взаимодействия оперируют понятиями о пяти основных типах межатомной связи: ван-дер-Ваальса, ионная, ковалентная, водородная , металлическая.
Связь ван-дер-Ваальса.
Она возникает между атомами, имеющими заполненные электронные оболочки (кристаллы инертных газов), а также между некоторыми типами органических молекул. На рис 13 приведена зависимость потенциальной энергии взаимодействия двух атомов инертных газов от расстояний между ними.
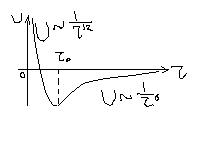
Справа ветвь дипольного взаимодействия (притяжения), слева ветвь квантово-механического взаимодействия (отталкивания).
Типичная энергия связи ван-дер-Ваальса невелика (порядка 0,2-0,3 эВ на атом).
Водородная связь.
Водородная связь реализуется при взаимодействии органических молекул, имеющих в составе электроотрицательные атомы (N,O,F и т.д.). При этом атом водорода может связать два элекроотрицательных атома двух молекул. Если молекулы содержат одинаково расположенные электроотрицательные элементы, то между ними может возникнуть несколько водородных связей. Благодаря водородным связям на длинной органической молекуле в растворе, содержащем более простые органические молекулы, может синтезироваться сложная органическая молекула, имеющая строго заданное расположение электроотрицательных элементов. Энергия водородной связи порядка 0,1 эВ на атом.
Ионная связь.
Кристаллы такого типа образуют элементы из первой и второй подгрупп, и 6-й и 7-й подгрупп с другой стороны. При этом электроны с верхних уровней элементов первой и второй подгрупп заполняют электронные оболочки элементов 6(7) подгрупп и оьразовавшиеся ионы связываются силами электростатического притяжения.
Электроотрицательностью атома называют энергию, которая выделяется при добавлении к элементу лишнего электрона. Формально электроотрицательность может быть положительной (атомы Cl, O, S) или отрицательной (щелочные и щелочноземельные металлы). Чем больше разница электроотрицательностей элементов, тем больше они склонны к образованию ионной связи. Ионная связь самая сильная и составляет около 6-7 эВ.
Ковалентная связь.
В чистом виде ковалентная связь образуется между элементами 4 подгруппы в кристаллах алмаза, кремния, германия. При этом электроны не переходят от атома к атому, а формируют общие электронные оболочки. Максимумы электронной плотности лежат посередине между атомами. Если в кристаллической решетке узлы заняты разнородными атомами, то в таких кристаллах реализуется ковалентная связь, имеющая частично ионный характер. Это означает, что максимумы элекронной плотности лежат не строго посередине между атомами, а сдвинуты в сторону одного из типов атомов. К таким соединениям относятся SixGe1-x.
Лекция 5. Металлическая связь.
Если в твердом теле зона проводимости частично заполнена, это означает, что электроны зоны проводимости коллективизируют и взаимодействуют со всеми атомами кристалла. Строгое квантово-механическое рассмотрение энергии образования металлического кристалла вызывает трудности, поэтому в материаловедении пользуются эмпирическими выражениями для энергии связи, основанными на обработке экспериментальных данных о сжимаемости, теплоте сублимации.
Например: 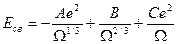 , где
, где 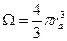 - объем, приходящийся на один атом, ra – среднее межатомное расстояние.
- объем, приходящийся на один атом, ra – среднее межатомное расстояние.
Первое слагаемое – потенциальная энергия электронов проводимости, второе слагаемое – кинетическая энергия электронов проводимости, третье слагаемое – потенциальная энергия валентных электронов.
Структура твердых растворов.
Типы твердых растворов.
В м-ведении твердые растворы подразделяют на две большие группы, в каждой из которых имеется три типа. Твердым раствором называется состояние двух- и более компонентного материала, при котором изменения соотношения компонентов в некотором интервале не приводят к изменению кристаллической решетки. Указанный интервал концентраций называется областью существования твердого раствора.
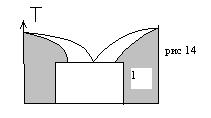
К первой группе относят твердые растворы, интервал существования которых на диаграмме состояния примыкает к одному из чистых компонентов, их называют ограниченными твердыми растворами (рис 14).
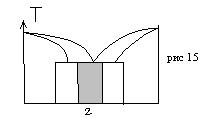
Ко второй группе относят твердые растворы интервал существования которых не примыкает к чистым компонентам. Их называют промежуточными фазами, валентными соединениями, интерметаллические соединения, соединениями бертоллидного типа (рис 15).
Основными типами твердых растворов являются растворы замещения, растворы внедрения, растворы вычитания.
В твердых растворах замещения атомы лигирующего компонента занимают узлы вместо атомов основного компонента.
В твердых растворах внедрения атомы лигирующего компонента занимают междоузлия в решетке основного компонента.
В твердых растворах вычитания атомы одного и другого компонента занимают строго фиксированные узлы кристаллической решетки.
Если в кристалле образуются вакансии атомов одного компонента, это эквивалентно изменению состава материала.
Правила Юм-Розери.
1. Если радиусы атомов компонентов отличаются более чем на 15%, то в системе образуются только ограниченные твердые растворы.
2. Если в системе имеются промежуточные фазы, это приводит к сужению областей существования ограниченных твердых растворов.
3. Ограниченные твердые растворы существуют при значениях электронной концентрации 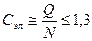 .
.
Э(электронным?) к-том сплава называют отношение числа валентных электронов в элементарной ячейке к числу атомов в элементарной ячейке. При подсчете числа валентных электронов учитывают s и p электроны, а для благородных металлов частично d группы.
Правила Юм-Розери были сформулированы на основе анализа диаграмм состояния двойных систем, они позволяют анализировать свойства 3-х, 4-х и более компонентных систем, для которых диаграмма состояния отсутствует.
Упорядочение в твердых растворах.
При определенных соотношениях содержания компонентов в твердом растворе атомы компонентов могут занять строго определенные узлы или междоузлия кристаллической решетки. Например, двойная система медь-золото при высоких температурах образует непрерывные твердые растворы, имеющие ГЦК решетку. Такую решетку можно представить в виде четырех простых кубических решеток, причем три из них сдвинуты относительно первой на половины диагоналей трех граней (см. рис. 8 б).
При сравнительно низких температурах атомы меди или золота могут занять соответственно узлы одной, двух или трех подрешеток. В этом случае говорят, что образовалась сверхструктура.
Диаграмма состояния медь-золото приведена на рис 16.
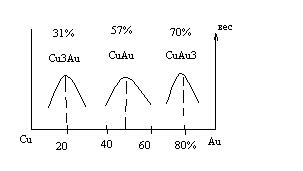
При упорядочении возрастает твердость и прочность сплава, поэтому сплавы меди и золота имеют такие составы для изготовления украшений.
При введении в чистое золото 2-3% меди твердость сплава резко возрастает. На этом основана 4-я ювелирная проба (975 проба).
– Конец работы –
Эта тема принадлежит разделу:
Лекция 1 Предмет изучения материаловедения
Объектом изучения материаловедения являются металлы сплавы стеклообразные и керамические мат лы композиционные мат лы... Основной задачей м ведения явл экспериментальное изучение зависимостей... Основными факторами влияющими на физ св ва мат ла сточки зрения м ведения являются структура мат ла и его фазовый...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Методы управления свойствами материала.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов