Итоги лекции N 8
1. Формула (8.3) для энергии стационарных состояний атома водорода, полученная на основе уравнения Шредингера совпадает с аналогичной формулой (4.8), полученной в боровской теории атома водорода, т.е.:
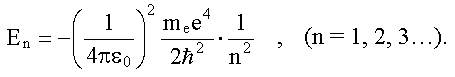
Здесь n называется главным квантовым числом.
2. Волновые функции ψnlm(r, θ, φ) стационарных состояний атома водорода определяются тремя квантовыми числами:
1) n - главное квантовое число, оно определяет энергию стационарных состояний;
2) l - азимутальное (или орбитальное) квантовое число, оно определяет момент импульса электрона (см. (8.4), (8.5)):
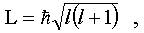
при заданном n квантовое число l может принимать следующие значения
l = 0, 1, ...(n - 1).
3) ml - магнитное квантовое число, оно определяет проекцию момента импульса на выбранное направление в пространстве, скажем ось z (см. (8.6), (8.7):
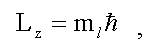
при заданном l магнитное квантовое число mе может принимать следующие значения:
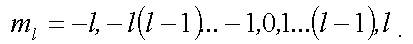
3. Появление в шредингеровской теории атома водорода квантования момента импульса L и его проекции Lz объясняет некоторые особенности спектров излучения и поглощения атома водорода, которые не могли быть объяснены теорией Бора.
4. Особенности спектров атома водорода связаны с тем, что фотон обладает собственным моментом импульса. Поэтому, вследствие закона сохранения момента импульса, момент импульса атома в процессах излучения и поглощения фотонов меняется. С наибольшей интенсивностью идут такие переходы, в которых выполняется следующее правило отбора для квантового числа l (см. (8.9)):
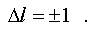
5. Шредингеровская теория атома водорода позволяет учесть влияние на энергетические уровни (а следовательно и на спектры излучения и поглощения) магнитного поля (эффект Зеемана) и электрического поля (эффект Штарка).
6. Шредингеровская теория атома водорода позволяет объяснить тонкую и сверхтонкую структуры спектров атома водорода на основе представления о собственном (спиновом) моменте импульса электрона.