Итоги лекции N 9
1. Электрон обладает собственным моментом импульса LS , не связанным с движением в пространстве. Модуль собственного момента импульса определяется спиновым квантовым числом S (см. (9.1)):
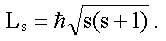
2. Проекция спина на ось z LSz квантуется (см. (9.2)):
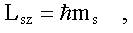
здесь ms - магнитное спиновое квантовое число, для электрона (см. (9.3)):
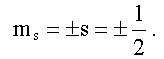
3. Квантовое состояние электрона в любом атоме задается четырьмя квантовыми числами:
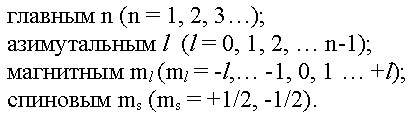
4. Частицы с полуцелым спином s относятся к фермионам (например - электрон), а частицы с целым спином - к бозонам (например - фотон).
5. Принцип Паули утверждает, что в квантовой системе фермионов две частицы не могут находиться в одном и том же квантовом состоянии.
6. Бозоны не подчиняются принципу Паули, они могут находиться в одинаковом квантовом состоянии в неограниченном количестве.
7. Периодическое повторение химических свойств элементов с ростом зарядового числа Z, открытое Д.И. Менделеевым, объясняется заполнением электронами квантовых состояний в атоме с учетом принципа Паули.
8. В молекулах различают два типа связи: ковалентную и полярную.
9. Ковалентная связь осуществляется за счет обобществления электронов, принадлежащих двум атомам.
10. Ионная связь обусловлена переходом электронов с одного атома на другой с образованием положительных и отрицательных ионов с электростатическим притягиванием между ними.
11. Энергия изолированной молекулы может быть приближенно представлена в виде:
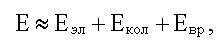
здесь Eэл - электронная энергия, она обусловлена электронной конфигурацией в молекуле; Eкол - энергия колебания ядер относительно центра масс молекулы Eвр - энергия вращения ядер относительно центра масс молекулы.
Порядки величин Eэл, Eкол и Eвр следующие:
Eэл ~ 1 ÷10 эВ;
Eкол ~ 10-2 ÷10-1 эВ;
Eвр ~ 10-5 ÷10-3 эВ.
12. Квантование колебательной и вращательной энергии молекулы объясняет экспериментально наблюдаемую зависимость теплоемкостей газов от температуры (см. § 4).
КВАНТОВАЯ ТЕОРИЯ СВОБОДНЫХ ЭЛЕКТРОНОВ В МЕТАЛЛЕ