БУФЕРНІ РОЗЧИНИ
1.8.1. Характерною властивістю буферних систем є:
а) постійність величини рН при розведенні або при додаванні невеликої кількості кислоти чи лугу;
б) незначна зміна значення рН при додаванні невеликої кількості кислоти;
в) зміна значення рН при розведенні;
г) незначна зміна рН додаванні невеликої кількості лугу.
1.8.2. Як впливає розведення буферних систем на значення рН:
а) не впливає; б) майже не змінює;
в) змінює значення рН в сторону кислого середовища;
г) змінює значення рН в сторону лужного середовища.
1.8.3. Величина рН буферних систем залежить:
а) від константи дисоціації слабкого електроліту і від співвідношення компонентів;
б) від співвідношення компонентів і температури;
в). від константи іонізації і не залежить від співвідношення компонентів;
г) від константи дисоціації і не залежить від тиску.
1.8.4. Для розрахунку рН буферного розчину необхідно знати:
а) константу дисоціації і співвідношення кислота: сіль:
б) тиск і температуру;
в) константу дисоціації і температуру;
г) співвідношення співвідношення кислота : сіль і тиск розчину.
1.8.5. рН кислотного буферу залежить від:
а) співвідношення компонентів; б) тиску;
в) температури; г) часу.
1.8.6. рН основного буферу залежить від:
а) природи речовин; б) тиску;
в) температури; г) часу.
1.8.7. Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; KHCO3; б) HNO3; NH4NO3;
в) H2CO3; NH4Cl; г) NH4OH; NaH2PO4.
1.8.8.Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; NH4Cl; б) HNO3; NH4NO3;
в) Na2HPO4; H3PO4; г)CH3COOH; CH3COONa.
1.8.9. Кислотним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.10. Основним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.11. Ацетатна буферна система представлена рівнянням:
а) СН3СООН + СН3СООNa
б) CH3COOH + NaSO4
в) CH3COOH + NaOH г) HCl + CH3COONa
1.8.12. Гідрокарбонатна буферна система представлена рівнянням:
а) H2CO3 + NaCl; б) H2CO3 + Na2CO3;
в) H2CO3 + NaHCO3; г) HCl + NaOH.
1.8.13. Ацетатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 3,7 – 5,6; б) 6,2 – 8,2;
в) 1,3 – 3,4; г) 5,8 – 6,9.
1.8.14. Амонійний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 8,4 – 10,3; б) 5,4 – 6,8;
в) 6,8 – 8,3; г) 4,1 – 5,6.
1.8.15. Фосфатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 5,9 – 8,0; б) 4,8 – 7,2;
в) 8,1 – 9,5; г) 3,2 – 5,8.
1.8.16. Яка із фосфатних буферних систем, що складається із 0,02 молярних розчинів Na2HPO4 i NaH2PO4 , поданих нище, має значення рН=6,81:
а) 40 мл Na2HPO4 та 40 мл NaH2PO4;
б) 10 мл Na2HPO4 та 20 мл NaH2PO4;
в) 20 мл Na2HPO4 та 30 мл NaH2PO4;
г) 25 мл Na2HPO4 та 40 мл NaH2PO4.
1.8.17. Ацетатна буферна система, яка відповідає значенню рН=4,65 складається з 0,01 молярних розчинів СН3СООН і СН3СООNa, які подані у об’ємах:
а) 20 мл СН3СООН та 20 мл СН3СООNa; б) 10 мл СН3СООН та 25 мл СН3СООNa;
в) 30 мл СН3СООН та 15 мл СН3СООNa; г) 20 мл СН3СООН та 10 мл СН3СООNa.
1.8.19 При якому співвідношенні кислота : сіль рН кислотної буферної системи найбільший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.20. При якому співвідношенні кислота : сіль рН кислотної буферної системи найменший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.21. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найбільша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.22. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найменша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.23. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти чи лугу:
а) електролітична дисоціація, протоліз, нейтралізація;
б) електролітична дисоціація, протоліз, гідроліз;
в) гідроліз, протоліз, нейтралізація;
г) окислення, гідроліз, протоліз.
1.8.24. Механізм дії буферних систем направлений на:
а) відновлення кислих і лужних продуктів;
б) окиснення кислих і лужних речовин;
в) нейтралізацію кислих і лужних продуктів;
г) гідроліз кислих і лужних продуктів.
1.8.25. Механізм дії на ацетатну буферну систему кислотою представлений в рівнянні:
а) СН3СОО- + Н3О+ ↔ СН3СООН + Н2О;
б) NН3∙H2O + H3O+ ↔ NH4+ + 2H2O;
в) H3O+ + HCO3- ↔ H2CO3 + H2O;
г) H3O+ + OH- ↔ 2H2O.
1.8.26. Механізм дії на амонійну буферну систему лугу представлений рівнянням:
а) OH- + H3O+ ↔ 2H2O;
б) NН3 ∙ H2O + H3O+ ↔ NH4+ + 2H2O;
в) OH- + HCO3- ↔ HCO3- + H2O
г) OH- + NH4+ ↔ NH3 ∙ H2O.
1.8.27. Механізм дії на гідрокарбонатну буферну системукислотою представлений в рівнянні:
а) Нb- + H3O+↔HHb + H2O;
б) H3O+ + OH- ↔ 2H2O;
в) HPO4-2 + H3O+ ↔ H2PO4- + H2O;
г) H3O+ + HCO3- ↔ H2CO3 + H2O.
1.8.28. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) H3O+ + HCO3- ↔ H2CO3 + H2O;
б) НСО-3 + OH- ↔ H2CO3
в) H2CO3 + OH- ↔ HCO-3 + H2O
г) H3O+ + OH- ↔ 2H2O.
1.8.29. Механізм дії на фосфатну буферну систему кислотою представлений:
а) НРО4-2 + Н3О+ ↔ Н2РО4- + Н2О
б) НРО4- + Н3О+ ↔ Н3РО4- + ОН-
в) Н2РО4- + ОН- ↔ НРО4-2 + Н2О+
г) НРО4-2 + Н2О+ ↔ Н2РО4- + ОН-.
1.8.30. Рівняння Гендерсона для підрахунку рН кислотних буферних систем:
а) 
б) 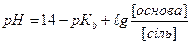
в) 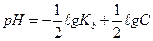
г)
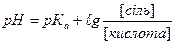
1.8.31. Рівняння Гендерсона для підрахунку рН основних буферних систем:
а) 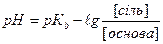
б) 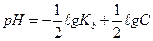
в) 
г) 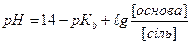
1.8.32. Для розрахунку рН основного буферу необхідно скористатись формулою:
а) 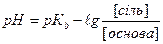
б) 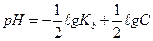
в) 
г) 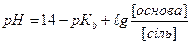
1.8.33. Біохімічні буферні системи організму:
а) гідрокарбонатна, фосфатна, гемоглобінова, білкова;
б) фосфатна, ацетатна, білкова, гідрокарбонатна;
в) гемоглобінові, білкова, фосфатна, амонійна;
г) білкова, ацетатна, амонійна, фосфатна.
1.8.34. Буферна дія – це здатність буферного розчину стійко зберігати сталу величину :
а) молярних концентрацій компонентів; б) рН;
в) константи дисоціації слабкого електроліту.
1.8.35.Склад буферних систем кислотного типу:
а) сильна кислота та основа;
б) слабка кислота та її сіль, що утворена сильною основою;
в) сильна кислота та її сіль, що утворена сильною основою.
1.8.36.Склад ацетатного буферу:
а) СН3СООН + СН3СООС2Н5;
б) СН3СООН + NaOH;
в) СН3СООН + СН3СООNa.
1.8.37.Склад гідрогенкарбонатного буферу:
а) H2CO3 + NaHCO3; б) H2CO3 + NаCl; в) NaHCO3 + NаCl.
1.8.38.Співвідношення компонентів гідрогенкарбонатного буферу в плазмі крові за
рН = 7,36 має бути:
а) 15 : 1; б) 20 : 1; в) 7 : 1; г)4 :1.
1.8.39.Склад фосфатного буфера:
а) Na3PO4 + NaH2PO4;
б) Na2 НPO4 + NaH2PO4;
в) Н3PO4 + NaH2PO4.
г) Н3PO4 + Na2PO4.
1.8.40. Співвідношення компонентів фосфатного буферу в плазмі крові за рН= 7,36 має бути:
а) 8 : 1; б) 10 : 1; в) 4 : 1.
1.8.41. Склад білкового буфера:
а) PtCOOH + PtCOOK;
б) PtCOOH + PtCONH2;
в) PtCOOH +( PtCOO)2Ca.
1.8.42. Формула білкової молекули як буфера:
а) Pt - COOH б) Pt - COOК
NH2 NH2
в) Pt - COCl г) Pt - COOH
NH2 NО2
1.8.43.Склад гемоглобінового буфера:
а) HHb + KHbО2; б) HHb + KHb;
в) HHb + NaHbО2.
1.8.44.Склад оксигемоглобінового буфера:
а) HHb + Са(HbО2)2; б) HHb + KHb; в) HhbО2 + КHbО2.
1.8.45.Склад буферних систем основного типу:
а) сильна кислота та слабка основа;
б) слабка основа та її сіль, що утворена сильною кислотою;
в) сильна кислота та її сіль, що утворена сильною основою.
1.8.46.Склад аміачного буфера:
а) NH4OH + NH4Cl; б) NH4OH + HCl; в) NH4NO3 + HNO3.
1.8.47. рН буферних систем залежить від:
а) величини КД та співвідношення компонентів;
б) величини КД та добутку компонентів;
в) величини КД та суми компонентів;
г) різниці компонентів.
1.8.48.Кислотно-лужна рівновага – це сталість в організмі людини величини:
а) осмотичного тиску;
б) артеріального тиску;
в) рН.
г) рОН.
1.8.49.Які органи та тканини підтримують кислотно-лужну рівновагу:
а) серце, шкіра, кістки; б) легені, нирки, кров; в) легені, зубна тканина, нирки.
1.8.50.Легені підтримують кислотно-лужну рівновагу в організмі людини:
а) виводячи воду;
б) виводячи вуглекислий газ;
в) виводячи солі.
г) виводячи кислоти.
1.8.51.Яка із буферних систем міститься у крові ?
а) CH3COOH б) R - COOH
СH3COONa
NH2
в) NH4OH г) Na2CO3
NH4NO3 Na2SO4
1.8.52.Механізм дії фосфатного буферу в крові:
а) NaН2PO4+НCl → Н3РО4+NaCl;
б) Na2HPO4+ NaOН → Na3PO4 +Н2О;
в) Na2HPO4 + НCl → NaH2PO4+NaCl.
1.8.53.Механізм дії гідрогенкарбонатного буферу в крові :
а) NaHСO3 + NaOH → Na2СO3 + H2O; б) NaHСO3 + НCl → NaCl + H2СO3;
в) NaHСO3 + NaOH → Н2СO3 + H2O.
1.8.54. Рівняння обчислення рН гідрогенкарбонатного буферу
А)  ;
;
Б) 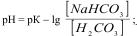
В) 
1.8.55. Формула обчислення рН для фосфатного буферу:
а)  ;
;
Б)  ;
;
В) 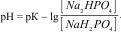
Г) –рК.