рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Программирование
- /
- З медичної хімії Комплексоутворення в біологічних системах
Реферат Курсовая Конспект
З медичної хімії Комплексоутворення в біологічних системах
З медичної хімії Комплексоутворення в біологічних системах - раздел Программирование, База Завдань На Модуль №1 ...
БАЗА ЗАВДАНЬ НА МОДУЛЬ №1
з медичної хімії «Комплексоутворення в біологічних системах»
для студентів спеціальностей «Лікувальна справа» та «Педіатрія»
Рівень
1.1. БІОГЕННІ s-, p-ЕЛЕМЕНТИ
1.1.1. Біогенними називаються елементи:
а) O, C, H, N, P, S. б) I, Zn, Cu, F, Fe;
в) Co, Ni, K, Na, Mg; г) Ca, P, Mg, Fe, Mn.
1.1.2. Елементи-органогени записані у ряді:
а) N,P,K,Mg,Cl, б) C,H,O,N,P,S,
в) C,H,O,Ca,F,Br, г) N,P,S,Ba,O,F.
1.1.3. Елементи-органогени VI групи записані у парі:
а) полоній, сульфур, б) оксиген, селен,
в) оксиген, сульфур, г) селен, телур.
1.1.4. Елементи-органогени V групи записані у парі:
а) бісмут, арсен, б) арсен, фосфор,
в) нітроген, стибій, г) нітроген, фосфор.
1.1.5. До s-елементів відносяться:
а) Na. Mg, Fe, S; б) Na, K, Mg, Ca;
в) O, C, H, N; г) Cu, Co, Fe, Zn.
1.1.6. До p-елементів відносяться:
а) Na. Mg, Fe, S; б) Na, K, Mg, Ca;
в) O, C, N. F; г) Cu, Co, Fe, Zn.
1.1.4. Макроелементи містяться в організмі людини в кількості:
а) >0,01%; б) <0,01%;
в) >0,001; г) <0,001%.
1.1.5. Мікроелементи містяться в організмі людини в кількості:
а) >0,01%; б) <0,01%;
в) >0,1; г) <0,1%.
1.1.7. До макроелементів (більше 0,01%) можна віднести –
а) F, Mg, Fe, Cd; б) Na, K, Сl, Ca;
в) Ca, Cu, Au, N; г) Mn, Co, Fe, Zn.
1.1.8 До макроелементів відносяться:
а) N, Р, K, O, S; б) Na, Cl, Co, Cu;
в) Mg, Na, Al, Si; г) Si, O, F, Fe.
1.1.9. До мікроелементів (10-3 – 10-6%) відносять:
а) Na, K, Сl, Ca, C; б) Mg, Zn, Сu, Fe, J;
в) Ca, Cu, Au, N, F; г) Mn, Cd, Ag, Cl, О.
1.1.10. До мікроелементіввідносяться:
а) Cu, Co, Ni, Mo; б) C, H, Mg, S;
в) Ag, Cu, O, F; г) Cl, Br, J, O.
1.1.11. До незаміннихелементів відносять:
а) Na, K, Сl, Ca, Cd; б) Mg, Zn, Сu, Fe, Hg;
в) Ca, Cu, Au, N, F; г) C, H, O, N, Ca.
1.1.12. До біокаталітичних елементів відносяться:
а) Na. Mg, Fe, S, Р; б) Na, K, Mg, Ca, Ва;
в) Cu, Zn, Mn, Co, Fe; г) O, C, N. F, Н.
1.1.13. Елементи С і О відносяться до:
а) органогенів; б) макроелементів;
в) мікроелементів; г) ультрамікроелементів.
1.1.14. Елементи Si і Se відносяться до:
а) органогенів; б) макроелементів;
в) мікроелементів; г) ультрамікроелементів.
1.1.15. Елементи Ca і P відносяться до:
а) органогенів; б) макроелементів;
в) мікроелементів; г) ультрамікроелементів.
1.1.16. Елементи Hg і Au відносяться до:
а) органогенів; б) макроелементів;
в) мікроелементів; г) ультрамікроелементів.
1.1.17. Елементи Na і K відносяться до:
а) органогенів; б) макроелементів;
в) мікроелементів; г) ультрамікроелементів.
1.1.18. ЙонNa+ має наступну електронну будову:
а) 1s22s22p63s2; б) 1s22s22p63s1;
в) 1s22s22p6; г) 1s22s22p5.
1.1.19. ЙонСа2+ має наступну електронну будову:
а) 1s22s22p63s2; б) 1s22s22p63s1;
в) 1s22s22p6; г) 1s22s22p5.
1.1.20. ЙонS6+ має наступну електронну будову:
а) s22s22p4 б) 1s22s22p63s23p4;
в) 1s22s22p6; г) 1s22s22p63s23p6.
1.1.21. ЙонS2- має наступну електронну будову:
а) 1s22s22p4 б) 1s22s22p63s23p4;
в) 1s22s22p6; г) 1s22s22p63s23p6.
1.1.22. Скільки неспарених електронів має атом Фосфоруу незбудженому стані?
а) 2; б) 3; в) 4; г) 5.
1.1.23. Скільки неспарених електронів має атом Сіліцію у незбудженому стані?
а) 2; б) 3; в) 4; г) 5.
1.1.24. Скільки неспарених електронів має атом Сульфуруу незбудженому стані?
а) 2; б) 3; в) 4; г) 5.
1.1.25.Скільки неспарених електронів має атом Хлору у незбудженому стані?
а) 2; б) 3; в) 4; г) 5.
1.1.26.Які хімічні властивості проявляють вищі оксид і гідроксид елемента з порядковим номером 12?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.27. Які хімічні властивості проявляють оксид і гідроксид елемента з порядковим номером 11?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.28. Які хімічні властивості проявляють оксид і гідроксид елемента з порядковим номером 13?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.29. Які хімічні властивості проявляють оксид і гідроксид елемента з порядковим номером 16?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.30. Які хімічні властивості проявляє N2O?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.31. Які хімічні властивості проявляє NO?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.32. Які хімічні властивості проявляє N2O3?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.33. Які хімічні властивості проявляє NO2?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.34. Які хімічні властивості проявляє N2O5?
а) основні, б) кислотні,
в) амфотерні, г) несолетворні.
1.1.35. Що спільного в будові атомів елементів з порядковими номерами 13 і 31?
а) заряд ядра, б) кількість електронів,
в) кількість енергетичних рівнів,
г) кількість електронів на зовнішньому рівні.
1.1.36. Що спільного в будові атомів елементів з порядковими номерами 6 і 9?
а) заряд ядра, б) кількість електронів,
в) кількість енергетичних рівнів,
г) кількість електронів на зовнішньому рівні.
1.1.37. Що спільного в будові атомів елементів з порядковими номерами 3 і 8?
а) заряд ядра, б) кількість електронів,
в) кількість енергетичних рівнів,
г) кількість електронів на зовнішньому рівні.
1.1.38. Що спільного в будові атомів елементів з порядковими номерами 7 і 15?
а) заряд ядра, б) кількість електронів,
в) кількість енергетичних рівнів,
г) кількість електронів на зовнішньому рівні.
1.1.39. Вкажіть набір порядкових номерів елементів, вищому оксиду яких відповідає кислота типу RO3:
а) 14 і 16; б) 13 і 14; в) 12 і 35; г) 16 і 34.
1.1.40. Вкажіть набір порядкових номерів елементів, вищому оксиду яких відповідає кислота типу RO2:
а) 14 і 16; б) 13 і 14; в) 14 і 32; г) 32 і 33.
1.1.41. Вкажіть набір порядкових номерів елементів, вищому оксиду яких відповідає кислота типу НRO4:
а) 17 і 18; б) 17 і 53; в) 14 і 17; г) 12 і 53.
1.1.42. Вкажіть набір порядкових номерів елементів, вищому оксиду яких відповідає кислота типу відповідає кислота типу Н2RO3:
а) 6 і 14; б) 14 і 16; в) 14 і 28; г) 12 і 34.
1.1.43 Сполуки Sr2+ забарвлюють полум’я в:
а) фіолетовий; б) кармінно-червоний;
в) жовтий колір; г) цегляно-червоний.
1.1.44.Сполуки К+ забарвлюють полум’я в:
а) фіолетовий; б) кармінно-червоний;
в) жовтий колір; г) цегляно-червоний.
1.1.45. Сполуки Сa2+ забарвлюють полум’я в:
а) фіолетовий; б) кармінно-червоний;
в) жовтий колір; г) цегляно-червоний.
1.1.46. Сполуки Вa2+ забарвлюють полум’я в:
а) фіолетовий; б) жовто-зелений;
в) жовтий колір; г) цегляно-червоний.
1.1.47. Сполуки Na+ забарвлюють полум’я в:
а) фіолетовий; б) жовто-зелений;
в) жовтий колір; г) цегляно-червоний.
1.1.48. Серед вказаних формул знайдіть формулу сполуки з ковалентним полярним зв’язком:
а) Cl2, б) NH3, в) N2, г) КClO3.
1.1.49.Серед вказаних формул знайдіть формулу сполуки з ковалентним неполярним зв’язком:
а) I2, б) PH3, в) SO2, г) KCl.
1.1.50. Серед вказаних формул знайдіть формулу сполуки з йонним зв’язком:
а) О2, б) NH3, в) N2О5, г) КCl.
1.1.51. Який р-елемент бере участь у синтезі статевих гормонів (тестостерона) і регулює функцію статевих залоз:
а) Br; б) Cl; в) I; г) Se.
1.1.52.НадлишокF- в організмі викликає захворювання:
а) флюороз; б) карієс зубів;
в) тиреотоксикоз; г) анемію.
1.1.53.Сульфат барію – практично-нерозчинна сіль застосовується в медицині:
а) для промивки гнійних ран;
б) для рентгенодіагностики хвороб ШКТ;
в) як антисептик; г) як обезболюючий засіб.
1.1.54. При дії BaCl2 на який аніон утворюється осад, нерозчинний в оцтовій кислоті?
а) SO42-; б) SO32-; в) PO43-; г) CO32-.
1.1.55. Природний дефіцит йоду в літосфері деяких біогеохімічний провінцій (зокрема в Карпатському регіоні) викликає захворювання:
а) флюороз; б) силікоз;
в) ендемічний зоб; г) анемію.
1.1.56. Бере участь у синтезі гормону інсуліну елемент:
а) Zn; б) Fe; в) Ag; г) Mn.
1.1.57. До складу гормону щитовидної залози тироксину входить елемент:
а) Se; б) Br; в) Cl; г) I.
1.1.58. Який галоген використовують у медичній практиці у вільному стані:
а) фтор, б) хлор, в) бром, г) йод.
1.1.59. Оксиди-елементів V А групи, які використовують у лікарській практиці, записані у парі:
а) N2O, As2O3, б) As2O3. P2O5,
в) NO, P2O5, г) NO2, N2O5.
1.1.60. Яку з галогеногідрогенних кислот містить шлунковий сік:
а) фторидну, б) хлоридну,
в) бромідну, г) йодидну.
1.1.61. При дефіцитi якого елементу в організмі виникає карієс зубів та який метод профілактики використовують:
а) хлору, хлорування води,
б) фтору, додавання фторидів до зубної пасти,
в) йоду, додавання йодидів до харчової солі,
г) бром, додавання бромідів до питної води.
1.1.62. При дефіциті якого елементу в організмі виникає ендемічний зоб та який метод профілактики використовують:
а) хлору, хлорування води,
б) фтору, додавання фторидів до зубної пасти,
в) йоду, додавання йодидів до харчової солі,
г) бром, додавання бромідів до питної води.
1.1.63. Як рентгенконтрасні засоби використовують сполуки елементів, записаних у парі:
а) стронцію, калію, б) плюмбуму, фтору,
в) барію, йоду, г) натрію, арсену.
1.1.64. Для приготування фізіологічного розчину використовують сполуку:
а) натрій хлорид, б) калій хлорид,
в) магній сульфат, г) натрій гіпохлорит.
1.1.65. Кістки та зуби містять такі сполуки фосфору:
а) Са3(РО4)2, б) Са3(Н2РО4)2,
в) Са5(РО4)3ОН, Са5(РО4)3F, г) Ca(HPO4)
1.1.66. Позаклітинними катіонами, в основному, є йони, записані у ряду:
а) Li+, Na+, Ca2+, б) K+, Na+, Ca2+ ,
в) Na+, Mg2+, K+, г) Li+, K+, Ca2+.
1.1.67. Внутрішньоклітинними катіонами, в основному, є іони, записані у парі:
а) K+, Mg+, б) K+, Na+,
в) Na+, Mg+, г) K+,Ca2+.
1.1.68. У молодого чоловіка, який часто вживає алкоголь, на фоні лікування сечогінними засобами виникла сильна м'язова і серцева слабість, блювота, діарея. Причиною такого стану є посилене виділення з сечею йонів:
а) K+, б) Na+, в) Cl¯, г) Ca2+.
1.1.69. Хворому поставлено діагноз –анемія. Недостача якого мінерального елементу призвів до даної патології?
а) Fe, б) Na, в) P, г) Mg.
1.1.70. До якого з йонів центральна нервова система є найбільш чутливою:
а) I-, б) Br-, в) F-, г) Ca2+.
1.1.71. Нітроген утворює кілька оксидів, один з них продукується судинами з метою їх розширення, інший – застосовують для наркозу. У якій парі записані ці оксиди:
а) N2O3, NO, б) NO2, NO,
в) N2O, NO, г) N2O5, NO2.
1.1.72. Професійною хворобою шахтарів є антрикоз. Дана хвороба викликана накопиченням у легенях елементу:
а) Si, б) Al, в) C, г) F.
1.1.73. Спиртовий розчин якого галогену використовують у медичній практиці:
а) брому, б) йоду, в) хлору, г) фтору.
1.1.74. Нашатирний спирт медичний – це є:
а) водний розчин аміаку,
б) спиртовий розчин аміаку,
в) водний розчин натрій хлориду,
г) спиртовий розчин йоду.
1.1.74 Назвати сполуки у вигляді яких літій застосовується в медицині:
а ) літію бромат; б) літію карбонат*;
в) літію барит; г) літію ацетат.
1.1.75. s-Елементами називають елементи:
а) в яких заповнюється зовнішній s-підрівень;
б) головних підгруп; в) малих періодів;
г) в яких заповнюється зовнішній p-підрівень.
1.1.76. p-Елементами називають елементи:
а) побічних підгруп; б) великих періодів;
в) в яких заповнюється зовнішній p-підрівень;
г) малих періодів.
1.1.77. d-Елементами називають елементи:
а) в яких заповнюється передостанній d-підрівень;
б) головних підгруп; в) малих періодів;
г) в яких заповнюється передостанній f-підрівень;
1.1.78. Головна функція цього р-елементу пов'язана з ростом і підтримкою цілісності кісткової тканини і зубів. В організмі дорослої людини його вміст до 86%:
а) Фосфор б) Сульфур
в) Кальцій г) Нітроген
1.1.79. Цей макроелемент входить до складу мембран клітин та нуклеїнових кислот, які беруть участь у процесах росту, ділення клітин, зберігання та використання генетичної інформації:
а) Фосфор б) Сульфур
в) Кальцій г) Нітроген
1.1.80. р-елемент VIIгрупи зменшує вірогідність розвитку карієсу, проте дуже великі дози можуть змінити колір зубів:
а) Фтор б) Хлор
в) Йод г) Астат
1.1.81 В організмі дорослої людини цей макроелемент складає від 1 до 1,5 кг
а) кальцію; б) Цинку
в) Аргентуму г) Меркурію
1.1.82. бере участь у процесі згортання крові:
а) кальцій б) Ферум
в) Хлор г) Бром
1.1.83. Цей мікроелемент метал входить до складу основного мінерального компонента кісткової тканини - оксиапатиту, мікрокристали якого утворюють жорстку структуру кісткової тканини:
а) кальцій б) Фосфор
в) Хлор г) Магній
1.1.83. Який s-елемент зменшує прояви алергічних реакцій при алергічних захворюваннях (сироваткова хвороба, кропив'янка, набряк Квінке, поліноз, бронхіальна астма)?
а) кальцій б) Фосфор
в) Хлор г) Магній
1.1.84. При дефіциті цього макроелементу відбувається порушення росту у дітей, викривлення хребта, кісток нижніх кінцівок, остеопороз, підвищена захворюваність карієсом, поява каменів у нирках:
а) Са б) К в) Р г) Н
1.1.85. Погане згортання крові, множинні синці на тілі внаслідок кровотеч з капілярів тканин, підвищена кровоточивість ясен відбуваються при недостачі такого s-елементу:
а) Са б) K г) Li д) Sr
1.1.86. Цей s-елемент разом з натрієм регулює водний баланс в організмі і нормалізує ритм серця:
а) Калій; б) Барій;
в) Натрій; г) Кальцій
1.1.87. Входить до складу внутрішньоклітинних рідин (50% всіх солей в організмі). Сприяє виведенню з організму зайвої води, допомагає ліквідувати набряки, затримку виділення сечі, необхідний для лікування водянки (асциту).
а) Калій; б) Барій;
в) Натрій; г) Кальцій.
1.1.88. Цей макроелемент нормалізує травлення стимулюючи апетит - оскільки активує фермент амілазу, яка бере участь в утворенні соляної кислоти - основного компонента шлункового соку:
а) Хлор; б) Фосфор;
в) Натрій; г) Кальцій.
1.1.89. Підтримує буферну систему крові, оскільки є головним катіоном позаклітинної рідини, регулює pH крові (концентрацію водневих іонів крові).
а) Натрій; б) Ванадій;
В) Калій; г) Хлор
1.1.90. s-елемент є найважливішим мінералом для серця, бере участь в обміні фосфору. Його дефіцит звичайне явище для людей, що піддаються хронічним стресам.
а) Магній; б) Натрій;
в) Ванадій; г) Хлор.
1.1.91. З наведених нижче сполук найбільш отруйною є:
а) CO; б) CO2;
в) CO(NH2)2; г) SiO2
1.1.92. Одна з класифікацій хімічних елементів грунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до р-елементів?
а) S, P, Cl ; б) K, Ca, Sc
в) Be, Mg, Al; г) Mn, Br, Mo
1.1.93. Одна з класифікацій хімічних елементів грунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до s-елементів?
а) K, Ca, Sc; б) S, P, Cl
в) Be, Mg, Al ; г) Mn, Br, Mo
1.1.94. Ряд неорганічних і органічних лікарських засобів містять атоми елементів з’єднані ковалентним полярним типом хімічного зв’язку. У яких з наведених сполук присутній тільки цей тип зв’язку?
а) H2SO4 ; б) NaCl
в) NH4Сl г) O2
1.1.95. Тіосульфат натрію використовують в медицині як протитоксичний, протизапальний та десенсибілізуючий засіб. Яка з наведених формул сполук є формулою тіосульфату натрію?
а) Na2S2O3; б) Na2S2O5 ;
в) Na2SO3; г) Na2S2O4
1.1.96. Хлорид кальцію застосовують при різних патологічних станах як засіб, що зменшує проникність судин, як кровоспинний засіб. Яка із наведених сполук служить для ідентифікації CaCl2?
а) AgNO3; б) KNO3;
в) HNO3; г) NaCl
1.1.97. Який із перерахованих елементів може проявляти тільки додатній ступінь окиснення ?
а) Магній; б) Бісмут;
в) Сульфур; г) Нітроген.
1.1.98. До розчинів даних солей долили кислоту. В якому випадку спостерігається виділення газу?
а) Na2CO3; б) K2SO4;
в) CuSO4; г) Na2SiO3.
1.1.99. Натрій йодид застосовують у медицині як:
а) Джерело мікроелементу йоду
б) Плазмозамінник
в) Заспокійливий засіб
г) Антацидний засіб
1.1.100. Натрій гідрогенкарбонат застосовують в медичній практиці для лікування захворювань, що супроводжуються ацидозом. До якого типу солей відноситься ця сполука:
а) кисла сіль ;
б) змішана сіль ;
в) середня сіль;
г) основна сіль.
1.1.101. Нітроген утворює сполуки з різними ступенями окислення, деякі з них відіграють важливу роль в організмі людини (регуляція серцево-судинної діяльності, кров’яного тиску). Для якої з даних сполук ступінь окиснення N є найменшим?
а) N2 ; б) NО;
в) N2О; г) NO2
1.1.102. Хлорактивні сполуки широко застосовуються як дезінфікуючі засоби. Яка з наведених формул відповідає гіпохлоритній кислоті?
а) HClO; б) HClO4;
в) HClO2 ; г) HClO3.
1.1.103. Який елемент у вигляді простої речовини є рідиною:
а) Бром; б) Фосфор;
в) Сірка; г) Водень
1.1.104. Солі карбонатної кислоти знаходять дуже поширене застосування. В медицині застосовують при захворюванні шлунку та кишечника, а також при печії, подагрі тощо одну з солей, яка в побуті зветься питною содою. Яка це сіль?
а) NaHCO3; б) Na2CO3;
в) K2CO3; г) Ca(HCO3)2.
1.1.105. В обміні речовин організму людини активно беруть участь біогенні макроелементи. Вміст якого макроелемента у позаклітиній рідині значно вищій, ніж в плазмі клітини?
а) Натрію; б) Калію;
в) Магнію; г) Брому.
1.1.106. Геміоксид нітрогену ( N2O ) використовується для інгаляційного наркозу і має назву:
а) звеселяючий газ;
б) Нашатирний спирт;
в) Протаргол;
г) Олеум .
1.1.107. Оксид нітрогену (I), відомий під назвою „звеселяючий газ”, у суміші з киснем використовують у медицині для наркозу. Вкажіть формулу цього оксиду.
а) N2O; б) NO;
в) NO2 ; г) N2O3.
1. 2. БІОГЕННІ d-ЕЛЕМЕНТИ
1.2.1.Ступінь окиснення d-елемента у сполуці K2Cr2O7:
а) +1; б) +2; в) +3; г) +4;
д) +5; з) +6; ж) +7.
1.2.2. Ступінь окиснення d-елемента у сполуці Na2CrO4:
а) +1; б) +2; в) +3; г) +4;
д) +5; з) +6; ж) +7.
1.2.3. Ступінь окиснення d-елемента у сполуціCr2(SO4)3:
а) +1; б) +2; в) +3; г) +4;
д) +5; з) +6; ж) +7.
1.2.4. Ступінь окиснення d-елемента у сполуці KMnO4:
а) +1; б) +2; в) +3; г) +4;
д) +5; з) +6; ж) +7.
1.2.5. Ступінь окиснення d-елемента у сполуці K2[Zn(OH)4]:
а) +1; б) +2; в) +3; г) +4;
д) +5; з) +6; ж) +7.
1.2.6. Ступінь окиснення d-елемента у сполуці AgNO3:
а) +1; б) +2; в) +3; г) +4;
д) +5; з) +6; ж) +7.
1.2.7. Якому d-елементу відповідає електронна конфігурація 3s23p63d24s2
а) Zn; б) Fe; в) Ag; г) Ті.
1.2.8. Якому d-елементу відповідає електронна конфігурація 3s23p63d54s1
а) Zn; б) Fe; в) Ag; г) Cr.
1.2.9. Якому d-елементу відповідає електронна конфігурація 3s23p63d64s2
а) Zn; б) Fe; в) Ag; г) Cu
1.2.10. Якому d-елементу відповідає електронна конфігурація 3s23p63d74s2
а) Zn; б) Fe; в) Ag; г) Co.
1.2.11. Якому d-елементу відповідає електронна конфігурація 3s23p63d104s2
а) Zn; б) Fe; в) Ag; г) Cu.
1.2.12. Якому d-елементу відповідає електронна конфігурація 4s24p64d105s1
а) Zn; б) Fe; в) Ag; г) Cu.
1.2.13. Які властивості проявляють оксид і гідрат оксиду Ті у ступені окиснення +2:
а) кислотні; б) основні;
в) амфотерні; г) несолетворні.
1.2.14. Які властивості проявляють оксид і гідрат оксиду Fe у ступені окиснення +2:
а) кислотні; б) основні;
в) амфотерні; г) несолетворні.
1.2.15. Які властивості проявляють оксид і гідрат оксиду Fe у ступені окиснення +3:
а) кислотні; б) основні;
в) амфотерні; г) несолетворні.
1.2.16. Які властивості проявляють оксид і гідрат оксиду Cr у ступені окиснення +3:
а) кислотні; б) основні;
в) амфотерні; г) несолетворні.
1.2.17. Які властивості проявляють оксид і гідрат оксиду V у ступені окиснення +5:
а) кислотні; б) основні;
в) амфотерні; г) несолетворні.
1.2.18. Які властивості проявляють оксид і гідрат оксиду Mn у ступені окиснення +7:
а) кислотні; б) основні;
в) амфотерні; г) несолетворні.
1.2.19. Який із наведених нижче йонів виявляє тільки властивості окисника:
а) Mn+7; б) Mn+2 в) Mn+3; г) Mn+4.
1.2.20. Який із наведених нижче йонів виявляє тільки властивості окисника:
а) Cr+6; б) Cr +2 в) Cr +3; г) Cr0.
1.2.21. Який із наведених нижче йонів виявляє тільки властивості окисника:
а) V+5; б) V +2 в) V+4; г) V+3.
1.2.22. Який із наведених нижче йонів виявляє тільки властивості відновника:
а) S-2; б) S 0 в) S +4; г) S+6.
1.2.23. Який із наведених нижче йонів виявляє тільки властивості відновника:
а) N-3; б) N 0 в) N +5; г) N+3.
1.2.24. Який із наведених нижче йонів виявляє властивості як окисника так і відновника:
а) Mn+4; б) Mn+7 в) Mn0; ) Mn+2.
1.2.25. Який із наведених нижче йонів виявляє властивості як окисника так і відновника:
а) Cr+3; б) Cr 0 в) Cr +6; г) Cr+2.
1.2.26. Скільки електронів приймає d елемент при відновленні в даній окисно-відновній реакції:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 +
а) 1; б) 2; в) 3; г) 5
1.2.27. Скільки електронів приймає d елемент при відновленні в даній окисно-відновній реакції:
KMnO4 + Na2SO3 + KOH → K2MnO4 +
а) 1; б) 2; в) 3; г) 5
1.2.28. Скільки електронів приймає d елемент при відновленні в даній окисно-відновній реакції:
KMnO4 + Na2SO3 + H2O → MnO2 +
а) 1; б) 2; в) 3; г) 5
1.2.29. Скільки електронів приймає d елемент при відновленні в даній окисно-відновній реакції:
FeSO4 + KMnO4 + + H2SO4 → Fe2(SO4)3+
а) 1; б) 2; в) 3; г) 5
1.2.30. Скільки електронів приймає d елемент при відновленні в даній окисно-відновній реакції:
KMnO4 + HCl → MnCl2+
а) 1; б) 2; в) 3; г) 5
1.2.31. Скільки електронів приймає d елемент при відновленні в даній окисно-відновній реакції:
K2Cr2O7 + K2SO3 + HCl → CrCl3 +
а) 1; б) 2; в) 3; г) 5
1.2.32. Який d-елемент входить в склад вітаміну В12?
а) Fe; б) Co; в) Mn; г) V.
1.2.33. Який з d-елементів входить до складу гемоглобіну і деяких ферментів, а також до складу м’язового білка міоглобіну:
а) Fe; б) Co; в) Mn; г) V.
1.2.34. Який d-елемент може інактивувати певні ділянки молекул ферментів, виступаючи ферментативною отрутою:
а) Fe; б) Co; в) Ag; г) Ti.
1.2.35. Який d-елемент проявляє ліпотропний ефект, знижуючи відкладення жиру в організмі:
а) Fe; б) Co; в) Mn; г) V
1.2.36. Який d-елемент впливає на діяльність залоз внутрішньої секреції, ріст і розвиток організму. Добова потреба збільшується в період росту, статевого дозрівання і під час вагітності:
а) Fe; б) Co; в) Zn; г) V.
1.2.37. Сполуки якого d-елемента є особливо токсичнимидля організму людини:
а) Cu б) Cd в) Ti г) Fe
1.2.38. Сполуки якого d-елемента є особливо токсичними для організму людини:
а) Cu; б) Tl; в) Ti; г) Fe.
1.2.39. Основна біологічна роль мікроелемента Mn ґрунтується на властивостях:
а) окисно-відновних; б) кислотно-відновних;
в) комплексотвірних; г) буферних.
1.2.40. Основна біологічна роль мікроелемента Cr ґрунтується на властивостях:
а) окисно-відновних;
б) кислотно-відновних;
в) комплексотвірних; г) буферних.
1.2.41. При виготовленні ліків, що містять КІ, необхідно враховуючи його окисно-відновні властивості. З якою із перелічених сполук КІ несумісний:
а) KCl; б) KI; в) H2O2; г) FeSO4.
1.2.42. Застосування гідроген пероксиду в медицині грунтується на окисних властивостях H2O2, які проявляються в реакції з:
а) KI; б) KMnO4; в) K2Cr2O7; г) H2O.
1.2.43. Які хімічні властивості зумовлюють використання в медицині як антисептика KMnO4:
а) здатність до повної дисоціації на іони; б) окисні властивості; в) відновні властивості;
г) відсутність гідролізу.
1.2.44. Якою зміною ступеня окиснення феруму супроводжується перенос електрона цитохромомС в організмі людини:
а) Fe0 → Fe+2; б) Fe+2 → Fe+3; в) Fe0 → Fe+3; г) Fe+2 → Fe+6.
1.2.45.Одним з шляхів видалення гідрогенпероксиду з організму є реакція
2Н2О2 = 2Н2О + О2.
До якого типу реакцій вона належить:
а) міжмолекулярного окиснення-відновлення;
б) внутрішньомолекулярного окиснення-відновлення;
в) диспропорціонування; г) нейтралізації.
1.2.46. Нітрит-йон проявляє токсичну дію, яку можна представити схемою:
HbFe+2 + NO-2 + 2H+ → HbFe+3 + NO + 2H2O
в якій NO-2 виконує роль:
а) окисника; б) відновника;
в) середовища; г) інгібітора.
1.2.47. Ферметативний процес окиснення аміаку в організмі відбувається за рівнянням:
2NН3 + 3О2 → 2Н+ + 2Н2О + 2NО
Скільки електронів віддає відновник в цій реакції:
а) 4; б) 6; в) 3; г) 8.
1.2.48. Нітрит-іон продуктується в організмі людини в кількості 400 мл за добу. Реагуючи з катіоном Fe+2 гемоглобіну він перетворюється в оксид нітрогену (ІІ), який розширює стінки судин. Скільки електронів приєднує нітрат-іон:
а) 1; б) 3; в) 4; г) 2.
1.2.49. Найважливішою функцією цього d-елементу вважють здатність прискорювати розпад пуринів і виводити з організму сечову кислоту, що при сприяє профілактиці розвитку подагри:
а) Молібден; б) Ферум;
в) Аурум; г) Тітан.
1.2.50. d-елемент необхідний для активності ряду ферментів, які беруть участь у тканинному диханні та синтезі аскорбінової кислоти, що сприяє нормальному росту і розвитку організму в цілому:
а) Молібден; б) Ферум;
в) Аурум; г) Тітан.
1.2.51. Дія мікроелементу молібдену на людський організм:
а) покращує ріст ;
б) Входить до складу інсуліну;
в) Зменшує набряки;
г) Входить до складу шлункового соку.
1.2.52. Який мікроелемент входить до складу ферменту, який відповідає за засвоєння та утилізацію заліза, у зв'язку з чим запобігає анемії?
а) молібден; б) Кадмій
в) Скандій; г) Літій.
1.2.53. Цей мікроелемент бере участь у регуляції жирового і вуглеводного обміну, утворенні кісткової і сполучної тканини, в обміні тироксину (гормону щитовидної залози):
а) Марганець; б) Меркурій
в) Ферум; г) Аурум
1.2.54. Необхідний для росту, відтворення, загоєння ран, максимально ефективної роботи мозку і правильного метаболізму цукру, інсуліну і холестерину. бере участь у регуляції обміну вітамінів С, Е, холіну і вітамінів групи В.
а) Марганець; б) Меркурій;
в) Ферум; г) Аурум
1.2.55. Нормалізує вуглеводний обмін, активно впливає на метаболізм інсуліну, що важливо для профілактики розвитку цукрового діабету.
а) марганець ; б) Меркурій;
вВ) Ферум; г) Аурум
1.2.56. Нормалізує роботу щитовидної залози - бере участь в обміні тироксину (гормону щитовидної залози) і, є ефективний для профілактики захворювань щитовидної залози, цукрового діабету, порушень жирового обміну, остеопорозу, хвороб суглобів.
а) марганець ; б) Меркурій;
в) Ферум; г) Аурум
1.2.57. Разом з інсуліном бере участь у метаболізмі цукру.
а) Хром; б) Кобальт;
в) Ферум; г) Сульфур.
1.2.58. Мікроелемент хром необхідний:
а) хворим на цукровий діабет (насамперед II типу);
б) Для лікування алкоголізму;
в) Для лікування «курячої сліпоти»;
г) Хворим з виразкою шлунку.
1.2.59. Мікроелемент, що сприяє зростанню і регенерації тканин і бере участь у синтезі нуклеїнових кислот - входить в структуру ДНК і РНК:
а) Хром; б) Кобальт;
в) Ферум; г) Сульфур.
1.2.60. Регулює роботу щитовидної залози , при нестачі йоду і певних умовах, здатний заміщати йод в тиреоїднихгормонах.
а) Хром; б) Кобальт;
в) Ферум; г) Сульфур.
1.2.61. Регулює ліпідний обмін - знижує рівень "поганого" холестерину в крові, запобігає розвитку атеросклерозу і серцево-судинних захворювань.
а) Хром; б) Кобальт;
в) Ферум; г) Сульфур.
1.2.62. Сприяє нормалізації ваги - нормалізуючи вуглеводний обмін, сприяє переробці жиру і запобігає його відкладення в м'язовій масі:
а) Хром; б) Кобальт;
в) Ферум; г) Сульфур
1.2.63. Достатній вміст в мозку підтримує його судини в хорошому стані і перешкоджає розвитку склерозу, запобігає ризику серцево-судинних захворювань, гіпертонії;
а) Ванадій; б) Натрій;
в) Калій; г) Хлор
1.2.64. Мікроелемент Ванадій використовують для:
а) нормалізації вуглеводного обміну (зокрема при лікуванні цукрового діабету)
б) Лікування безпліддя
в) Лікування неврозів
г) лікування виразки шлунку.
1.2.65. Препарати цього мікроелементу мають протипухлинну дію - стимулють правильний поділ клітин організму:
а) Ванадій; б) Натрій
в) Калій; г) Хлор
1.2.66. Цей мікроелемент бере участь у регуляції водно-сольового балансу (підтримка балансу натрію і калію в організмі), що дозволяє підтримувати нормальний артеріальний тиск, знижувати набряки, регулювати роботу м'язової та нервової тканин:
а) Ванадій; б) Натрій
в) Калій; г) Хлор.
1.2.67. Мікроелемент бере участь у регуляції процесів кровотворення і впливає на рівень гемоглобіну в крові - засвоюється організмом за допомогою молекул-переносників, подібних до тих, які транспортують залізо:
а) Ванадій; б) Натрій;
в) Калій; г) Хлор.
1.2.68. Цей мікроелемент бере участь у формуванні кісткового скелета - сприяє накопиченню солей кальцію в кістках, бере участь у формуванні зубів, підвищує їх стійкість до карієсу.
а) Ванадій; б) Натрій
в) Калій; г) Хлор
1.2.69. Залізо є одним з незамінних мікроелементів. Яку важливу дію в органзмі він виконує?
а) бере участь у тканинному диханні ;
б) Є ферментативною отрутою
в) Впливає на водний баланс організму
г) Нормалізує ліпідний обмін.
1.2.70. Основна дія Цинку в організмі людини:
а) імуностимулююча
б) транспорт Кисню
в) Синтез тироксину
г) Зниження збудливості і депресивних станів.
1.2.71. Цей мікроелемент при взаємодії з марганцем підвищує вироблення статевих гормонів, збільшує активність сперматозоїдів, сприяє правильному функціонуванню та розвитку чоловічих статевих залоз:
а) Цинк; б) Кадмій;
в) Молібден; г) Аурум
1.2.72. є важливою речовиною для підтримки та поліпшення зору, особливо багато цинку міститься в сітківці ока, тому він важливий для профілактики короткозорості, підвищує здатність адаптації до темряви (при лікуванні «курячої сліпоти»):
а). Цинк; б) Кадмій;
в) Молібден; г) Аурум
1.2.73. Він регулює рівновагу цукру в крові, тому що є одним з компонентів інсуліну.
а) Цинк; б) Кадмій;
в) Молібден; г) Аурум
1.2.74. Різка затримку росту (карликовість) виникає при недостачі мікроелементту:
а) Цинк; б) Кадмій;
в) Молібден; г) Аурум
1.2.75. Різні розлади статевої функції, що призводять до бездітності (головним чином, через атрофію статевих залоз у чоловіків, недорозвиненості статевих органів); простатит і аденома передміхурової залози; передчасні пологи і народження ослаблених, маленьких дітей виникає при недостачі мікроелементту:
а) Цинк; б) Кадмій;
в) Молібден; г) Аурум.
1.2.76. Ураження головного мозку: психічні розлади (апатія, депресія, сплутаність свідомості, посилення симптомів шизофренії, епілепсії), неврологічні порушення (втрата смакових відчуттів, порушення слуху та зору) виникає при недостачі мікроелементту:
а) Цинк; б) Кадмій
в) Молібден; г) Аурум
1.2.77. Сульфат міді (II) використовують як антисептичний та в’яжучий засіб в офтальмології, гінекології, урології, а також як протиотруту при отруєнні білим фосфором. При взаємодії з надлишком водного розчину аміаку CuSO4 утворює сполуку, яка містить іон:
а) [Cu(NH3)4]2+ ; б) CuOH+
в) [Cu(NH3)2] + ; г) [Cu(OH)NH3] +
1.2.78. Нітрат срібла застосовують в офтальмології як бактерицидний, протизапальний засіб. Вказати реагент, який може служити для ідентифікації Ag+:
а) NaCl ; б) KNO3
в) Ва(NO3)2 г) (NH4)2СO3
1.2.79. Сульфат заліза (II) входить як складова частина до засобів, які застосовують при лікуванні залізодефіцитних анемій. З якою з наведених сполук реагує FeSO4:
а) KMnO4; б) HCl
в) CO2; г) FeCl2
1.2.80. Що являє собою перетворення Cr+3 > CrO42-
а) окислення в лужному середовищі
б) окислення в кислому середовищі
в) відновлення в кислому середовищі
г) відновлення в нейтральному середовищі
1.2.81. Що являє собою перетворення MnO4- > MnO2
а) відновлення в нейтральному середовищі
б) окислення в кислому середовищі
в) відновлення в кислому середовищі
г) окислення в лужному середовищі
1.2.82. Зміна кислотно-лужних властивостей в сполуках MnO > MnO2 > Mn2O7 відповідає закономірності
а) кислотні властивості підсилюються
б) основні властивості підсилюються
в) кислотно-лужні властивості не змінюються
г) кислотні властивості зменшуються
1.2.83. Ферум (ІІІ) гідроксид проявляє амфотерні властивості тому що:
а) реагує з кислотами і основами
б) реагує тільки з кислотами
в) реагує тільки з основами
г) диспропорціонує
1.2.84. Серед елементів ІІВ групи амфотерні властивості проявляють:
а) тільки цинк; б) цинк і кадмій;
в) кадмій і ртуть г) тільки ртуть
1.2.85. Калій перманганат в реакції з гідроген пероксидом у кислому середовищі проявляє властивості:
а) окисника;
б) відновника;
в) диспропорціонує;
г) окисника та відновника;
1.2.86. Купруму сульфат застосовують як:
а) Антисептичний засіб
б) Антацидний засіб
в) Проносний засіб
г)Заспокійливий засіб
1.2.87. Сполуки Au використовують для лікування:
а) туберкульозу; б) Гастриту
в) Безпліддя; г) Анемії
1.2.88. Меркурію хлорид (сулема) використовується як:
а) Антисептичний засіб
б) Антацидний засіб
в) Проносний засіб
г) Заспокійливий засіб
1.2.89. При відновленні калій перманганату у нейтральному середовищі утворюється сполука мангану:
а) MnO2 ; б) К2MnO4;
в) MnO; г) MnSO4
1.2.90. Ферум у сполуках може знаходитись у різних ступенях окиснення. Який найвищий ступінь окиснення феруму у сполуках:
а) +6; б) +8; в) +3; г) +4
1.2.91. Механізм токсичної дії сполук Плюмбуму полягає у:
а) зв’язуванні SH - груп ферментних систем;
б) утворенні метгемоглобіну у крові;
в) зменшенні величини рН крові;
г) збільшенні величини осмотичного тиску крові.
1.2.92. Марганець відноситься до біометалів, концентрується в печінці, відповідає за функцію утворення піровиноградної кислоти. Яка сполука марганцю є найсильнішим окисником?
а) КMnO4 ; б) MnO2;
в) MnO; г) Mn2O3.
1.2.93. Хром відноситься до мікроелементів, бере участь в процесах обміну глюкози. Вкажіть, якій закономірності відповідає зміна кислотно-основних властивостей в ряді сполук CrO - Cr2O3 - CrO3?
а) Кислотні властивості підсилюються
б) Основні властивості підсилюються
в) Кислотно-основні властивості не змінюються
г) Кислотні властивості зменшуються
1.2.94. За один день організм людини потребує 5-10мг хрому, він приймає участь в стабілізації структури нуклеїнових кислот, входить до складу ферменту трипсину. Вказати йон, яка є якісним реагентом на хромати:
а) Ag+; б) К+; в) Na+; г) Ca2+.
1.2.95. Цинк належить до групи незамінних мікроелементів. Знаходиться в печінці, молочних залозах, сітчастій оболонці ока. Вибрати сполуку цинку, яку використовують в дерматології, в основі «цинкової мазі» для загоєння ран:
а) ZnO; б) Zn(OH)2 ;
в) Zn(NO3)2; г) ZnCl2.
1.2.96. Цинк належіть до мікроелементів, а розчин цинк сульфату ZnSO 4 використовують у медицині як очні краплі. Вкажіть до якого типу солей відноситься ця сполука:
а) Середні; б) Кислі;
в) Основні; г) Комплексні.
1.2.97. Вкажіть, в якому ступені окиснення Манган та Хлор виявляє найбільшу схожість у властивостях :
а) +7; б) +3;
в) 0; г) +4
1.2.98. Аргентум нітрат застосовують в офтальмології як бактерицидний, протизапальний засіб. З яким із йонів AgNO3 утворює білий сирнистий осад?
а) Cl-; б) NO3-; в) SO42-; г)NO2-
1.2.99. Ферум в організмі людини входить до складу гемоглобіну та ряду ферментів. Недостача заліза в організмі викликає:
а) анемію; б) Остеопороз;
в) Карієс; г) Флюороз.
1.3.КОМПЛЕКСНІ СПОЛУКИ
1.3.1. Для комплексної сполуки [Ag(NH3)2]OH йон Ag+ є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.2. Для комплексної сполуки [Ag(NH3)2]OH група частинка NH3+ є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.3. Для комплексної сполуки [Ag(NH3)2]OH група OH- є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.4. Для комплексної сполуки [Ag(NH3)2]OH йон [Ag(NH3)2]+ є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.5. Для комплексної сполуки Fe4[Fe(CN)6]3 йон Fe+3 є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.6. Для комплексної сполуки Fe4[Fe(CN)6]3 йон Fe+2 є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.7. Для комплексної сполуки Fe4[Fe(CN)6]3 група CN- є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.8. Для комплексної сполуки Fe4[Fe(CN)6]3 йон [Fe(CN)64-] є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.9. Для комплексної сполуки [Cu(NH3)4](OH)2 йон Cu2+ є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.10. Для комплексної сполуки [Cu(NH3)4](OH)2 молекула NH3 є:
а) комплексоутворювачем;
б) лігандом;
в) зовнішньою сферою;
г) внутрішньою сферою.
1.3.11. Комплексоутворювач повинен бути:
а) акцептором електронів, мати вільні електронні орбіталі;
б) нейтральною частинкою;
в) оксигеновмісним,
г) донором електронних пар.
1.3.12. Лігандповинен бути:
а) акцептором електронів, мати вільні електронні орбіталі;
б) нейтральною частинкою;
в) оксигеновмісним,
г) донором електронних пар.
1.3.13. Характерним типом зв’язку між комплексоутворювачем і лігандами є зв’язок:
а) ковалентний; б) йонний;
в) донорно-акцепторний г) водневий.
1.3.14. В якій із комплексних сполук комплексоутворювачем є Fe2+:
а) K4[Fe(CN)6]; б) K3[Fe(CN)6];
в) Fe(OH)2Cl г) Fe2(SO4)3
1.3.15. В якій із комплексних сполук
комплексоутворювачем є Fe3+:
а) K4[Fe(CN)6]; б) K3[Fe(CN)6];
в) Fe(OH)2Cl г) Fe2(SO4)3
1.3.16. Який з перелічених катіонів можуть бути комплексоутворювачем?
а) K+; б) Na+ в) Co2+ г) NH4+
1.3.17. Яка з частинок може стати комплексоутворювачем?
а) OH-; б) Cu2+; в) СN-; г) Н2О;
1.3.18. Яка з частинок може стати комплексоутворювачем?
а) Fe2+; б) Cl-; в) OH-; г) Br-;
1.3.19. Яка з частинок може стати комплексоутворювачем?
а) Co3+; б) OH-; в) СN-; г) SCN;
1.3.20. Яка з частинок може стати комплексоутворювачем?
а) Al3+; б) H2O; в) SО42-; г) OH-;
1.3.21.. Яка з частинок може стати лігандом?
а) Cu2+; б) Cu+; в) Ag+; г) OH-;
1.3.22. Яка з частинок може стати лігандом:
а) Fe2+; б) Cl-; в) Fe3+; г) Zn2+;
1.3.23.Яка з частинок може стати лігандом:
а) NН3; б) Mg2+; в) Cu2+; г) Cr3+;
1.3.24. Яка з частинок може стати лігандом:
а) H2O; б) Zn2+; в) Al3+; г) Sn2+;
1.3.25. В якій із наведених сполук H2O є лігандом:
а)CuSO4*5H2O; б) K[Al(OH)4(H2O)2];
в) [Zn(NH3)2](OH)4 г)FeSO4•7H2O;
1.3.26. В якій із наведених сполук ціанід-йон є лігандом:
а) Zn(СN)2; б) K2[PtCl4];
в)K2[Au(CN)4]; г) Fe(CN)3
1.3.27. В якій із наведених сполук хлорид-йон є тільки лігандом:
а) ZnCl2; б) K2[PtCl4];
в) [Ag(NH3)2]Cl; г) [PtCl2]Cl2;
1.3.28. Яка із перелічених частинок може грати роль ацидного ліганда:
а) Cl-; б) NH3; в) СО; г) NH4+;
1.3.29. Яка із перелічених частинок може грати роль нейтрального ліганда:
а) Cl-; б) NH3; в) СN; г) OH-;
1.3.30. Яка із перелічених частинок може грати роль акваліганда:
а) Cl-; б) NH3; в) СО; г) Н2О;
1.3.31. При дії надлишку розчину гідроксиду амонію на катіон Cu2+ утворюються:
а) гідроксиди цих металів;
б) основні солі цих металів;
в) аквакомплекси;
г) аміакaтні комплекси цих сполук.
1.3.32. При дії надлишку розчину гідроксиду амонію на катіон Cо2+ утворюються:
а) гідроксиди цих металів;
б) основні солі цих металів;
в) аквакомплекси;
г) аміакaтні комплекси цих сполук.
1.3.33. При дії надлишку розчину гідроксиду амонію на катіон Zn2+ утворюються:
а) гідроксиди цих металів;
б) основні солі цих металів;
в) аквакомплекси;
г) аміакaтні комплекси цих сполук.
1.3.34. Ціанкобаламін (вітамін В12) є комплексною сполукою кобальту. До якого типу комплексних сполук він належить?
а) катіонних комплексів; б) аквакомплексів;
в) ціанідних комплексів;
г) хелатних комплексів.
1.3.35. Хлорофіл є комплексною сполукою магнію. До якого типу комплексних сполук він належить?
а) катіонних комплексів; б) аквакомплексів;
в) ціанідних комплексів;
г) хелатних комплексів.
1.3.36. Гемоглобін є комплексною сполукою заліза. До якого типу комплексних сполук він належить?
а) катіонних комплексів; б) аквакомплексів;
в) ціанідних комплексів;
г) хелатних комплексів.
1.3.37. Амінокислоти можуть утворювати комплекси з йонами кобальту. До якого типу комплексних сполук він належить?
а) катіонних комплексів; б) аквакомплексів;
в) ціанідних комплексів;
г) хелатних комплексів.
1.3.38. Комплексна сполука, що сприяє участі рослин у фотосинтезі називається:
а) гемоглобін; б) ціанкобаламін;
в) трилон Б; г)хлорофіл.
1.3.39. Які із наведених речовин грають роль комплексону в хелатотерапії?
а)трилон Б; б) амінооцтова кислота ;
в)сода г)аміак.
1.3.40 Для наведеної комплексної сполуки K2[HgI4] вказати комплексоутворювач:
а) Hg2+ ; б) K+;
в) I– ; г) HgI42–
1.3.41. Вкажіть тип реакції, що застосовують для якісного визначення катіону Fe3+:
а) комплексоутворення;
б) осаждення
в) гідролізу
г) окиснення-відновлення
1.3.42. Реалізація якого типу хімічного зв’язку обов’язкова в комплексних сполуках?
а) Донорно-акцепторного ;
б) Йонного ;
в) Ковалентного;
г) Водневого .
1.3.43. Яка координаційна формула сполуки з сумарним складом PtCl4•6NH3, якщо координаційне число Pt (IV) дорівнює 6?
а) [Pt(NH3)6]Cl4 ;
б) [Pt(NH3)6]Cl2
в) [Pt(NH3)4]Cl4
г) [Pt(NH3)6]Cl3
1.3.44. Яка з наведених комплексних сполук є катіонним комплексом:
а) [Cr(H2O)4Cl2]Cl ; б) H2[PtCl6]
в) Na3[Co(NO2)6] ; г) K3[Fe(CN)6]
1.3.45. Ртуть здатна утворювати сполуки, в яких проявляє ступінь окислення +1 або +2. В якій з наведених формул сполук, ртуть проявляє ступінь окислення +2
а) K2[HgI4]; б) Hg2Cl2
в) Hg2O; г) Hg2(NO3)2•2H2O
1.3.46. Визначити комплексну сполуку, заряд центрального атома-комплексоутворювача якої дорівнює +3
а) K3[Fe[CN]6]; б) [Pt[NH3]2Cl2]
в) K2[Mn[CN]4] ; г) K2[PtCl4]
1.3.47. Який вид ізомерії має місце для комплексної сполуки [Pt[NH3]2Cl2]
а) геометрична; б) оптична
в) гідратна; г) іонізаційна
1.3.48. Присутність якого з іонів d-елементів у розчинах можна встановити за допомогою K4[Fe[CN]6]
а) Fe3+; б) Fe2+;
в) Zn2+; г) Cr3+
1.3.49. Вказати комплексну сполуку, в якій комплексоутворювачем є Pt(IV):
а) [Pt(NH3)4Cl2] Cl2 ;
б) K2[PtCl4];
в) Ba [Pt(CN)4];
г) [Pt(NH3)4](NO3)2;
[Pt(NH3)2Cl2];
1.3.50. Купрум (ІІ) гідроксид утворює з лугами комплексні сполуки, в яких купрум проявляє координаційне число:
а) 4; б) 5; в) 6; г) 3
1.3.51. Жовта кров’яна сіль K 4[Fe(CN) 6] є реактивом на:
а) іони Fe3+ ; б) іони Fe2+ ;
в) іони Ca2+; г) іони FeO42-.
1.3.52. Гем (складова частина гемоглобіну) є комплексною сполукою Феруму. До якого типу комплексних сполук він належить?
а) Хелатних комплексів
б) Ацідокомплексів
в) Аквакомплексів
г) Катіонних комплексів
1.3.52. Дихлордіамінплатину використовують у медицині як протипухлинний засіб. Серед наведених сполук вкажіть цей лікарський препарат:
а) [Pt(NH3)2Cl2]
б [Pt(NH3)4]Cl2
в) [Pt(NH3)3Cl]Cl
г) [Pt(NH3)4](NO3)2
1.3.53. Комплексна сполука [Pt(NH3)2Cl2] утворює цис- і транс-форми. Назвіть вид ізомерїї:
а) геометрична; б) іонізаціонна;
в) гідратна; г) координаційна
1.3.54. Деякі лікарські засоби відносять до комплексних сполук. Укажіть який з лігандів є бідентатним.
а) Оксалат-іон; б) Гідроксид-іон;
в) Аміак; г) Хлорид-іон.
1.3.55. Який ступінь окиснення має центральний іон у сполуці Н2[PtCl6]?
а) +4; б) 0; в) +2; г) +3.
1.4. РОЗЧИНИ
1.4.1. Розчин, в якому речовина при певній температурі більше не розчиняється, називають:
а) насичений; б) ненасичений;
в) розведений; г) пересичений.
1.4.2. В шлунковому соці людини розчиненою речовиною є:
а) соляна кислота; б) натрій гідроксид;
в) вода; г) сірчана кислота.
1.4.3. Щоб збільшити розчинність газу, треба:
а) понизить температуру;
б) підвищити температуру;
в) підвищити тиск; г) понизить тиск.
1.4.4. При збільшенні температури,розчинність речовини:
а) зменшується; б) збільшується;
в) не змінюється;
г) спочатку збільшується, а потім зменшується.
1.4.5. Тиск впливає на розчинність речовини:
а) рідкої; б) твердої;
в) газоподібної; г) нерозчинної.
1.4.6. Вибрати фактор, який збільшує розчинність твердих речовин:
а) пониження температури;
б) підвищення температури;
в) підвищення тиску; г) пониження тиску.
1.4.7. Хлорид натрію розчиняється у воді і не розчиняється в бензолі. Це пояснюється:
а) різною природою хімічного зв’язку у молекулах води і бензолу;
б) різною густиною води і бензолу;
в) різними ступенями окиснення атомів гідрогену у воді і у бензолі;
г) різними молярними масами у води і бензолу.
1.4.8. Вибрати формулу для знаходження масової концентраціїрозчину:
а) Cm = 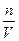 ; б)
; б) 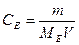 ;
;
в) Cн = 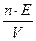 г) ω =
г) ω =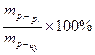
1.4.9. Вибрати формулу для знаходження молярної концентраціїрозчину:
а) 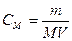 ; б)
; б) 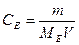 ;
;
в) Cн =  г) ω =
г) ω =
1.4.10. Вибрати формулу для знаходження молярної концентрації еквівалентів розчину:
а) Cm = 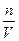 ; б)
; б) 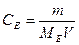 ;
;
в) Cн = 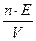 г) ω =
г) ω =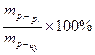
1.4.11. Формула для обчислення моляльності водних розчинів:
а) Сm = 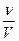 ; б) Bx =
; б) Bx =  ;
;
в)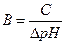 ; г) ω =
; г) ω = ;
;
1.4.12. Моляльна концентрація (моляльність) – це відношення кількості розчиненої речовини (моль) до:
а) маси розчину; б) об’єму розчину;
в) маси розчинника; г) об’єму розчинника.
1.4.13. Масова частка розчиненої речовини в розчині позначається як:
а) ν; б) СМ; в) ρ; г) ω.
1.4.14. Масова частка розчиненої речовини в розчині виражається в:
а) г/л; б) моль/л; в) г/дм3; г) %.
1.4.15. “Визначити масову частку речовини в розчині” означає:
а) знайти масу речовини, розчинену в 100 г води;
б) знайти масу речовини, розчинену в 100 г розчину;
в) знайти масу речовини в певній масі розчину;
г) знайти масу речовини в певному об’ємі розчину.
1.4.16. Молярна концентрація розчиненої речовини позначається як:
а) ν; б) СМ; в) ρ; г) ω.
1.4.17. Молярна концентрація розчиненої речовини виражається в:
а) г/л; б) моль/л;
в) г/дм3; г) відсотках (%)
1.4.18. Вибрати позначення одномолярного розчину:
а) 1 М; б) 2 н; в) 1 дм3; г) 1%.
1.4.19. Титр розчину визначає:
а) кількість г в 1 мл розчину;
б) кількість молів в 1 л розчину;
в) кількість г в 100 мл розчину;
г) кількість г в 1 л розчину.
1.4.20. Фізіологічний розчин – це:
а) 0,5%- розчин NaCl; б) 5%- розчин NaCl;
в) 0,9%- розчин NaCl; г) 8%- розчин глюкози.
1.4.21. Фізіологічний розчин – це:
а) 0,5%- розчин NaCl; б) 5%- розчин NaCl;
в) 9%- розчин NaCl; г) 5%- розчин глюкози.
1.4.22. Який фактор еквівалентності для сполуки фосфатної кислотив реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.23. Який фактор еквівалентності для сульфатної кислотив реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.24. Який фактор еквівалентності для сполуки гідроксиду хрому(ІІІ) в реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.25. Який фактор еквівалентності для сполуки гідроксиду амоніюв реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.26. Який фактор еквівалентності для сполуки натрію хлориду в реакціях обміну, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.27. Який фактор еквівалентності для натрію карбонату:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.28. Який фактор еквівалентності для натрію гідрокарбонату:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.29. Який фактор еквівалентності для сполуки хлориду алюмінію:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.30. Який фактор еквівалентності для сполуки хлориду барію в реакціях обміну, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.31. Який фактор еквівалентності для сполуки купруму сульфату в реакціях обміну, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.32. Який фактор еквівалентності для амонію сульфату:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.33 Молярна маса еквіваленту сульфатної кислотив реакціях повного йонного обміну становить (в г/моль):
а) 98; б) 4,9; в) 49; г) 9,8.
1.4.34. Молярна маса еквіваленту фосфатної кислотив реакціях повного йонного обміну становить (в г/моль):
а. 98; б. 49; в. 24,5; г. 32,67.
1.4.35. Молярна маса еквіваленту гідроксиду амонію в реакціях обміну становить (в г/моль):
а) 78; б) 39; в) 35; г) 19,5.
1.4.36. Молярна маса еквіваленту сульфату амонію в реакціях обміну рівна (в г/моль):
а) 114; б) 57; в) 342; г) 171.
1.4.37. Молярна маса еквіваленту фосфату кальцію в реакціях повного йонного обміну становить (в г/моль):
а) 51,67; б) 310; в) 155; г) 103,33;
1.4.38. В хірургії для дезінфекції рук використовують розчин:
а) мурашиної кислоти; б) NaОН;
в) NaCl; г) Н2SО4;
1.4.39. Тимчасова твердість води зумовлена наявністю у природній воді слідуючих солей кальцію та магнію
а) гідрокарбонатів
б) сульфатів;
в) хлоридів;
г) нітратів.
1.4.40. При зберіганні відкритої колби з розчином солі на дні колби утворились кристали. Яким буде розчин над кристалами?
а) Насиченим; б) Ненасиченим;
в) Пересиченим; г) Розбавленим.
1.4.41. Вода з високою твердістю непридатна для використання у фармацевтичній промисловості. Які з наведених речовин можна використати з метою пом’якшення води?
а) Na2CO3, NaOH
б) CaCO3, Ca(OH)2
в) Na3PO4, CaCl2
г) MgSO4, H2SO4
1.4.42. Природна вода завжди містить розчинені солі. Яка з наведених солей може зумовлювати тимчасову твердість води?
а) Mg(HCO3)2 ; б) NaCl;
в) CaСl2 ; г) MgCl2
1.4.43. Для приготування 1 л 0,1 М розчину сульфатної кислоти (М(H2SO4)=98 г/моль) необхідно взяти:
а) 9,8 г H2SO4 ; б) 980 г NaCl;
в) 0,098 г NaCl; г) 49 г NaCl
1.4.44. Вкажіть речовину яка має однакові значення молярної та еквівалентної мас:
а) HCl; б) Na2SO4;
в) H3PO4 г) Al2(SO4)3
1.4.45. Нашатирний спирт – це водний розчин з масовою часткою аміаку:
а) 10%; б) 3%;
в) 5% ; г) 15%
1.4.46. Для приготування 500 г 10% гіпертонічного розчину натрію хлориду необхідно:
а) 50 г NaCl; б) 0,5 г NaCl
в) 25 г NaCl; г) 75 г NaCl
1.4.47. У середньому людина вживає 6-7 кг кухонної солі на рік. Яка маса іонів хлориду вводиться в організм людини щоденно, якщо вважати, що людина з`їла впродовж року приблизно 5,85 кг NaCl?
а) ~ 10 г ; б) ~ 1 г;
в) ~ 0,6 г; г) ~ 6 г .
1.4.48. Розрахуйте масу натрій хлориду для приготування 100 г ізотонічного (0,9%) розчину, який використовують для внутрішньовенного введення.
а) 0,9 г ; б) 1,8 г;
в) 18 г; г) 0,36 г
1.4.49. Фактор еквівалентності кислот – це одиниця поділена на
а) валентність кислотного залишку;
б) число атомів гідрогену, що заміщується на метал;
в) число атомів гідрогену, що входить до кислоти.
1.4.50. Фактор еквівалентності основ – це одиниця поділена на:
а) валентність оксигруп; б) число атомів металу; в) число оксигруп.
1.4.51. Фактор еквівалентності солей – це одиниця поділена на:
а) валентність металу;
б) ступінь окислення металу;
в) сумарну валентність металу.
1.4.52. Фактор еквівалентності в окисно – відновних реакціях – це одиниця
поділена на:
а) число електронів, що приймає окисник, або віддає відновник;
б) число електронів, що бере участь в реакції;
в) зміна ступеня окиснення.
1.4.53. Молярна маса еквіваленту – це:
а) добуток молярної маси речовини на фактор еквівалентності;
б) добуток маси речовини на фактор еквівалентності;
в) відношення молярної маси речовини до фактору еквівалентності.
1.4.54. Молярна концентрація еквіваленту – це:
а) відношення маси еквівалента речовини до об’єму розчину;
б) кількість речовини в одиниці об’єму розчину;
в) кількість моль еквівалентів речовини в одиниці об’єму розчину.
1.4.55. За законом еквівалентів:
а) 
б) 
в) 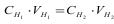
г)
1.5. ОСНОВИ ТИТРИМЕТРИЧНОГО АНАЛІЗУ
1.5.1. В титриметричному методі аналізу використовується вимірювання:
а) маси; б) об’єму;
в) тиску; г) температури.
1.5.2. Який мірний посуд застосовують для виміру об’єкту титранту:
а) мензурка; б) мірна колба;
в) бюретка; г) мірний циліндр.
1.5.3. Стандартний розчин в титриметрії – це:
а) розчин невідомої концентрації яким титрують;
б) розчин невідомої концентрації який титрують;
в) розчин відомої концентрації яким титрують;
г) розчин відомої концентрації який титрують.
1.5.3. Досліджуваний розчин в титриметрії – це:
а) розчин невідомої концентрації яким титрують;
б) розчин невідомої концентрації який титрують;
в) розчин відомої концентрації яким титрують;
г) розчин відомої концентрації який титрують.
1.5.4. Що таке титрований розчин?
а) Розчин, який досліджують титруванням;
б) Розчин, титр якого відомий до початку титрування;
в) Розчин, концентрація якого стала відомою після титрування.
1.5.4. Що таке досліджуваний розчин?
а) Розчин, який досліджують титруванням;
б) Розчин, титр якого відомий до початку титрування;
в) Розчин, концентрація якого стала відомою після титрування.
1.5.5. В титриметричних методах аналізу концентрацію робочого розчину виражають в:
а) моль/л; б) г/л; в) %; г) г•моль/л.
1.5.6. В титриметричних методах аналізу концентрацію досліджуваного розчину виражають в:
а) моль/л; б) г/л; в) %; г) г•моль/л.
1.5.7. Закон еквівалентів визначає відношення між кількістю еквівалентів досліджуваної речовини і стандартного розчину:
а) більше стандартного розчину;
б) більше досліджуваної речовини;
в) однакове;
г) менше стандартного розчину.
1.5.8. Закон еквівалентів для будь-якої пари взаємодіючих речовин можна виразити:
а) 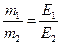 ; б)
; б)  ;
;
в)  б)
б)  .
.
1.5.9. Математичний вираз закону еквівалентів:
а) СЕ1∙V1 = CE2∙V2; б)  ;
;
в) 
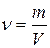 ; г)
; г) 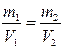 .
.
1.5.10. Титр розчину виражають в:
а) г/л; б) моль/л;
в) г/мл; г) г/моль
1.5.11. Молярну концентрацію еквіваленту речовини в розчині виражають в:
а) моль/л; б) г/моль;
в) г/мл; г) моль/кг.
1.5.12. Точкою еквівалентності називають момент реакції, коли:
а) припинено титрування;
б) спостерігається зміна середовища;
в) кількість еквівалентів досліджуваного і робочого розчину однакова;
г) кількість еквівалентів досліджуваного і робочого розчину різна.
1.5.13. Встановити точку еквівалентності в методі нейтралізації можна за допомогою:
а) зміни забарвлення індикатора;
б) нагрівання; в) перемішування;
г) додавання відповідного реагенту.
1.5.14. Індикатори – це органічні барвники складної будови, які змінюють своє забарвлення залежно від:
а) нагрівання; б) охолодження;
в) рН-розчину; г) концентрації.
1.5.15. Зміна забарвлення індикатора при кислотно-основному титруванні показує:
а) середовище розчину;
б) точку еквівалентності;
в) кількість кислоти; г) кількість лугу.
1.5.16. В якому середовищі буде точка еквівалентності при титруванні сильної кислоти сильною основою:
а) сильно кислому; б) слабокислому;
в) нейтральному; г) слабо основному.
1.5.17. В якому середовищі буде точка еквівалентності при титруванні слабкої кислоти сильною основою:
а) сильно кислому; б) слабокислому;
в) сильноосновному; г) слабоосновному.
1.5.18. В якому середовищі буде точка еквівалентності при титруванні сильної кислоти слабкою основою:
а) сильно кислому; б) слабокислому;
в) сильноосновному; г) слабоосновному.
2.5.14. В якому випадку скачок рН при титруванні буде зміщуватись в лужну сторону?
а) при титруванні слабкої кислоти лугом;
б) при титруванні сильної кислоти лугом;
в) при титруванні слабкої кислоти слабкою основою;
в) при титруванні сильної кислоти слабкою основою;
2.5.15. Точка еквівалентності при титруванні сильної основи сильною кислотою знаходиться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.16. Точка еквівалентності при титруванні слабкої кислоти лугом знаходиться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.17. Точка еквівалентності при титруванні слабкої основи сильною кислотою знаходиьться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.18. Що таке зворотне титрування?
а) в присутності індикатора титрування робочого розчину досліджуваним розчином;
б) титрування надлишку робочого розчину, доданого до досліджуваного;
в) титрування в присутності індикатора робочим розчином досліджуваний розчин.
2.5.19. На яких реакціях ґрунтуються титриметричні методи ацидиметрії і алкаліметрії?
а) на реакціях нейтралізації кислот, фенолів, амінів, амінокислот, основ.
б) на реакціях осадження в певному середовищі (рН);
в) на окисно-відновних реакціях за участю окисників і відновників.
1.5.20. Які класи речовини можна визначити методом ацидиметрії?
а) кислоти і солі; б) солі і основи;
в) кислоти і основи.
1.5.21. Які класи речовин можна визначити методом алкаліметрії?
а) кислоти і солі; б) солі і основи;
в) кислоти і основи.
1.5.22. Чи можна розрахувати молярну концентрацію еквіваленту речовини в розчині за результатами титриметричного (об’ємного) аналізу?
а) так; б) ні;
в) тільки за масою наважки.
1.5.23. Чи можливо за точною наважкою КОН приготувати «стандартний розчин» для титриметричного аналізу?
а) так; б) ні; в) після попередньої очистки.
1.5.24. Ацидиметрія – це метод визначення вмісту:
а) основ у розчині титруванням стандартним розчином кислот;
б) багатоосновних кислот у розчині титруванням розчином натрій гідроксиду;
в) кислот у розчині титруванням стандартним розчином основ;
г) гідросульфітів у розчині титруванням стандартним розчином натрій гідроксиду.
1.5.25. В методі ацидометрії робочим розчином є розчин з точно відомою концентрацією:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.26. Методом ацидометрії можна визначити концентрацію:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.27. В методі алкаліметрії робочим розчином є розчин з точно відомою концентрацією:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.28. Методом алкаліметрії можна визначити концентрацію:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.29. Розчин якої речовини використовується як титрант при алкаліметричному визначенні:
а) натрій гідроксиду; б) хлоридної кислоти;
в) натрій хлориду; г) сульфітної кислоти.
1.5.29. Кислотність шлункового соку визначають у клінічних одиницях (к.о.), які виражаються об’ємом:
а) 0,1М розчину лугу, що пішов на титрування 100см3 профільтрованого шлункового соку;
б) 0,1М розчину кислоти, що пішов на титрування 100см3 профільтрованого шлункового соку;
в) 0,01М розчину лугу, що пішов на титрування 100см3 профільтрованого шлункового соку;
г) 0,01М розчину кислоти, що пішов на титрування 100см3 профільтрованого шлункового соку.
1.5.30. Загальна кислотність є:
а) вищою за вільну кислотність;
б) нищою за вільну кислотність;
в) рівною вільній кислотністі;
г) нищою за зв’язану кислотність.
1.5.31. Чому дорівнює молярна маса еквівалента сульфатної кислоти у реакції з натрій гідроксидом:
а) 49 г/моль; б) 98 г/моль;
в) 196 г/моль; г) 49 г.
1.5.32. Чому дорівнює молярна маса еквівалента хлоридної кислоти у реакції з кальцій гідроксидом:
а) 36,5 г/моль; б) 18,25 г/моль;
в) 36 г; г) 73 г/моль.
1.5.33. Чому дорівнює молярна маса еквівалента натрій гідроксиду у реакції з сульфатною кислотою:
а) 20 г/моль; б) 40 г/моль;
в) 40 г; г) 80 г/моль.
1.5.34. Молярна маса еквіваленту Al2(SO4)3 складає (г/моль):
а) 171; б) 114; в) 57; г) 342.
1.5.35. Чому дорівнює молярна маса еквівалента аміаку у реакції з хлоридною кислотою :
а) 17 г/моль; б) 34 г/моль;
в) 2 моль; г) 14 г/моль.
1.5.36. Вкажіть фактор еквівалентності fекв. оксалатної кислоти у реакції:
Н2С2О4 + 2NaOH = Na2С2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.37. Вкажіть фактор еквівалентності fекв. натрій гідроксиду у реакції:
Н2С2О4 + 2NaOH = NaС2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.38. Вкажіть фактор еквівалентності fекв. сульфатної кислотиу реакції з амоній гідроксидом:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.39. Вкажіть фактор еквівалентності fекв. амоній гідроксиду у реакції з хлоридною кислотою:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.40. Вкажіть фактор еквівалентності fекв. кальцій гідроксиду у реакції з сульфатною кислотою:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.41. Вкажіть фактор еквівалентності fекв. ацетатної кислотиу реакції з барій гідроксидом:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.42. Вкажіть фактор еквівалентності fекв. барій гідроксиду у реакції з оксалатною кислотою:
Н2С2О4 + Вa(OH)2 = ВaС2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.43. Тимчасова твердість води обумовлена наявністю в ній солей:
а) Na2CO3 і CaCO3; б) Ca(HCO3)2 і MgSO4;
в) Ca(HCO3)2 Mg(HCO3)2.
1.5.44. Постійна твердість води обумовлена наявністю в ній солей:
а) CaCl2, MgSO4; б) CaCO3, MgCO3;
в) MgSO4, CaCO3
1.5.45. Вода вважається твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.46. Вода вважається м’якою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.47. Вода вважається нормальної твердості, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.48. Вода вважається дуже твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.49 В яких одиницях вимірюють твердість води:
а) г/л; б) кг/л; в) ммоль-екв/л; г) моль/л.
1.5.50. Вода вважається твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.51. Вода вважається м’якою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.52. Вода вважається нормальної твердості, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.53. Вода вважається дуже твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.54 В яких одиницях вимірюють твердість води:
а) г/л; б) кг/л; в) ммоль-екв/л; г) моль/л.
1.5.55. Одним з показників якості води, що використовується у фармацевтичній промисловості, є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
*а) MgCl2; б) KCl;
в) Ca(HCO3)2; г) Mg(HCO3)2
1.5.56. У фармацевтичному аналізі, в якості титранту використовують 0,1 М розчин хлоридної кислоти. Який об'єм цієї кислоти можна приготувати виходячи з 100 мл 0,5 М розчину HCl?
*а) 500мл; б) 50 мл;
в) 200 мл ; г) 1000 мл .
1.5.57. Титриметричний метод аналізу – це метод:
а) кількісного аналізу кислот, основ, солей;
б) кількісного аналізу досліджуваного розчину в процесі титрування;
в) якісного аналізу кислот, основ, солей в процесі титрування.
1.5.58. Процес титрування – це:
а) повільне додавання одного розчину до іншого;
б) повільне додавання одного розчину до іншого до настання еквівалентної
точки;
в) повільне додавання одного розчину до води.
1.5.59. Вимоги, до реакцій в титриметричному аналізі:
а) повинні проходити швидко, кількісно, не бути зворотніми; можливість встановлення еквівалентної точки;
б) повинні проходити швидко, кількісно, бути зворотніми;
в) повинні проходити повільно, кількісно, не бути зворотніми, можливість встановлення еквівалентної кількості.
1.5.60. Точну концентрацію за даними титрування розраховують за формулою:
а)  ; б)
; б) 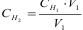 ;
;
в) 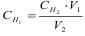
1.5.61. Для приготування титрованих розчинів використовують:
а) мірний циліндр; б) мірну колбу;
в) мірний хімічний стакан; г) піпетку.
1.5.62. Який хімічний посуд використовують для відбору проби для титрування:
а) мірна колба; б) піпетка;
в) бюретка; г) стакан.
1.5.63. Забарвлення метилоранжу в кислому середовищі:
а) рожевий; б) жовтий;
в) безбарвний.
1.5.64. Забарвлення метилоранжу в лужному середовищі
а) рожевий; б) жовтий;
в) безбарвний.
1.5.65. Інтервал переходу забарвлення метилоранжу:
а) 3,1-4,4; б) 8,2-10,0;
в) 4,0-10,0.
1.5.66. Фенолфталеїн в кислому середовищі:
а) рожевий; б) малиновий;
в) безбарвний.
1.5.67. Фенолфталеїн в лужному середовищі має забарвлення:
а) рожеве; б) малинове; в) безбарвний.
1.5.68. Інтервал переходу забарвлення індикатора фенолфталеїна:
а) 3,1-4,4; б) 3,1-8,2; в) 8,2-10,0.
1.5.69. Яка реакція лежить в основі кислотно-основного титрування:
а) окиснення; б) осадження; в) нейтралізації.
1.5.70. Основне рівняння методу нейтралізації:
а) [Н+] + [ОН−] = Н2О; б) Н+ + ОН− = Н2О; в) [Н+] + [ОН−] = 10−14.
1.5.71. Робочі розчини в методі нейтралізації:
а) Н2С2О4⋅2Н2О, Н2SO4, NaOH, KOH;
б) Н2SO4, HCl, Na2CO3, NaOH;
в) NaOH, KOH, Н2SO4, HCl.
1.5.72. Методом нейтралізації можна визначати:
а) кислоти, відновники;
б) кислоти, основи, солі, які не піддаються гідролізу;
в) кислоти, основи, солі, які піддаються гідролізу.
1.5.73. Класи сполук, які визначаються методом кислотно-основного титрування:
а) кислоти, основи, окисники;
б) кислоти, основи, солі, які не піддаються гідролізу;
в) кислоти, основи, солі, які піддаються гідролізу.
1.5.74. Криві титрування – це:
а) зміна забарвлення розчину в процесі титрування;
б) графічне зображення зміни реакції середовища в процесі титрування;
в) зміна об’єму розчинів в процесі титрування.
1.5.75. Криві титрування показують:
а) зміну об’ємів розчинів при титруванні;
б) залежність рН системи від зміни об’єму титрованого розчину;
в) графічне зображення зміни індикатора.
1.5.76. Стрибок титрування – це:
а) різка зміна рН під час титрування; б) різка зміна рН поблизу еквівалентної точки;
в) момент кінця реакції.
1.5.77. Еквівалентна точка – це:
а) точка кінця реакції;
б) рН, за якого сполуки прореагували в рівних кількостях;
в) рН, за якого сполуки прореагували в еквівалентних кількостях.
1.5.78. Основне рівняння методу ацидіметрії:
а) [Н+] / [ОН−] = Н2О; б) Н+ + ОН− = Н2О; в) [Н+] + [ОН−] = 10−14.
1.6. КИСЛОТНО-ОСНОВНІ РІВНОВАГИ. рН.
1.6.1. Які з перелічених груп речовин відносять тільки до елекролітів:
а) NaCl, CaCl2, KOH;
б) KOH, C2H5OH, NaCl;
в) Na2B4O7 10H2O, HCOOH, NaCl.
г) C6H12O6, C2H5OH, H2SO4.
1.6. 2. Які з перелічених груп речовин відносять тільки до неелектролітів:
а) C6H12O6 , C2H5OH;
б), KCl, C2H5OH;
в) NaCl H2SO4;
г) С12Н22О11, СН3СНСООН.
1.6. 3. Які із наведених речовин відносять до слабких електролітів?
а) NaCl, б) CH3COOH;
в) Na2SO4; г) HCl.
1.6.4. Які із наведених речовин відносять до слабких електролітів?
а) Н2О, б) NaCl;
в) HCl; г)CCl3COOH.
1.6.5. Які із наведених речовин відносять до слабких електролітів?
а) C2H5OH, б) CCl3COOH;
в) NaCl; г) H2SO4.
1.6.6. Які із наведених речовин відносять до cильних електролітів?
а) NaCl; б) BaSO4;
в) Ca3(PO4)2; г) H2O.
1.6.7. Які із наведених речовин відносять до cильних електролітів?
а) BaSO4; б) H2O;
в) MgCl2; г) H2O.
1.6.8. Які із наведених речовин відносять до cильних електролітів?
а) CaCl2; б) CaCO3;
в) Ca3(PO4)2; г) AgCl.
1.6.9. Згідно з теорією Бренстеда і Лоурі основами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп;
б) донорами протонів (іонів гідрогену);
в) акцепторами протонів;
г) акцепторами електронної пари.
1.6.10. Згідно з теорією Бренстеда і Лоурі основами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп;
б) донорами протонів (йонів гідрогену);
в) акцепторами протонів;
г) акцепторами електронної пари.
1.6.11. Водневий показник записується як вираз:
а) [H+]; б) [OH-]; в) pH; г) pOH.
1.6.12. Як записати йонний добуток води?
а) [H3O+]*[OH-]=10-14 б) 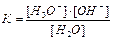
в) 
 г)
г) 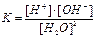
1.6.13. Яка формула використовується для розрахунку рН розбавленого розчину HCl?
а) рН = -ℓg[Н+]; б) рН = 14 – рОН;
в) рН = - ℓgСОН- г) рН = -ℓg[Н+]∙2
1.6.14. Закон розведення Оствальда можна виразити:
а) 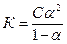 б)
б) 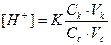
в) Р=СRT; г) рН=14-рОН
1.6.15. Яке значення рН в кислих розчинах?
а) рН=0-5; б) рН>7; в) рН=5-7; г) рН<7.
1.6.16. Яке значення рН в лужних розчинах?
а) рН=0-5; б) рН>7; в) рН=5-7; г) рН<7.
1.6.17. Ступінь дисоціації (α) для слабких електролітів при с (електроліту) = 0,1 моль/л за температури 250С має значення:
а) α=0; б) α<1; в) α<0,1; г) α<0,03.
1.6.18. Що таке ацидоз?
а) зміщення рН середовища в організмі у лужну сторону;
б) розрідження крові внаслідок плазмолізу;
в) зміщення рН середовища в організмі у кислу сторону;
г) підвищене згортання крові.
1.6.19. Що таке алкалоз?
а) зміщення рН середовища в організмі у лужну сторону;
б) підвищення чутливості організму до окремих ліків;
в) підвищення згортання крові;
г) нервове збудження.
1.6.20. Ацидоз – це відхилення рН крові до:
а) 8,3; б) 8,0; в) 7,2; г) 7,5.
1.6.21 Алкалоз – це відхилення рН крові до:
а) 6,5; б) 6,8; в) 7,1; г) 7,5.
1.6.22. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) і зменшення резервної лужності називають:
а) анабіозом; б) алкалозом;
в) ацидозом; г) антагонізмом.
1.6.23. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) і збільшення резервної лужності називається:
а) анабіозом; б) ацидозом;
в) алкалозом; г) антагонізмом.
1.6.24. Вибрати рівняння гідролізу соди і рН середовища в розчині
а) H2SO4 + NaOH → рН=7
б) HCl + Na2CO3 → рН<7
в) H2CO3 + NaOH → рН<7
г) H2O + Na2CO3 → рН>7
1.6.25. Міра активної кислотності середовища:
а) ступінь дисоціації;
б) константа дисоціації;
в) рН розчину;
г) об’єм 0,1 М розчину NaOH, затраченого на титрування.
1.6.26. Що таке активна кислотність?
а) ступінь дисоціації кислоти;
б) концентрація йонів Н+ в розчині;
в) константа дисоціації кислоти;
г) відтитрована кислотність середовища.
1.6.27. Інтервал рН, що відповідає поняттю «підвищена» кислотність шлункового соку:
а) рН=0,9; б) рН<1,9; в) рН<4,5; г) рН=7.
1.6.28. Чи одинакові активна і загальна кислотність у розчині сульфатної кислоти
а) так, б) ні, активна більша;
в) ні, загальна більша; г) ні, активна менша.
1.6.29. Чи одинакова активна і загальна кислотність у розчині HCl?
а) ні; б) більша активна;
в) так; г) більша загальна.
1.6.30. Чи однакові активна і загальна кислотність у розчині оцтової кислоти?
а) загальна менша; б) активна менша;
в) активна набагато більша; г) так.
1.6.31. Імовірне значення рН крові людини в нормі:
а) рН=7; б) рН=7,2;
в) рН=7,36; г) рН=7,56.
1.6.32. Яке порушення кислотно-лужної рівноваги може наступити, якщо рН плазми крові стане 7,55?
а) кислотність зросте; б) наступить алкалоз;
в) наступить ацидоз; г) відбудеться плазмоліз.
1.6.33. Імовірні границі зміни значення рН слини:
а) 6,5-7,5; б) 5.6-7,9;
в) 6,0-8,6 г) 7,0-8,6.
1.6.34. Значення рН сечі людини знаходиться в межах:
а) 4,8 – 5,8; б) 6,5 – 8,5;
в) 2,2 – 5,0; г) 5,0 – 6,5.
1.6.35. Фізіологічне значення рН сечі:
а) 1-3; б) 3-6; в) 5-8; г) 6-9.
1.6.36. Можливі границі зміни рН сльозової рідини:
а) 7,6-7,8; б) 7,0-7,6;
в) 7,7-8,7 г) 8,0-8,7.
1.6.37. Чому дорівнює в середньому рН слини в нормі:
а) 5,0; б) 6,75; в) 7,75; г) 8,25.
1.6.38. Імовірне значення рН шлункового соку в нормі:
а) 0,6; б) 1,05; в) 1,65; г) 2,05.
1.6.39. Інтервал рН, що відповідає поняттю «знижена» кислотність шлункового соку:
а) рН > 7,36; б) рН > 0,9;
в) рН > 1,65; г) рН > 2,0.
1.6.40. Інтервал рН, що відповідає поняттю «нульова» кислотність шлункового соку:
а) рН > 7; б) рН >1,65;
в) рН > 1,0; г) рН > 2,0.
1.6.41. Концентрація йонів гідроксилу 0,0001 моль/л. Яке рН розчину?
а) 10; б) 9; в) 4; г) 5.
1.6.42. Концентрація йонів водню в розчині Сн+= 0,001 моль/л. Підрахувати рН розчину.
а) рН=0,0001; б) рН=0,1;
в) рН=2; г) рН=3.
1.6.43. Знайти концентрацію ОН-йонів у морській воді, якщо її рН = 8,0.
а) [ОН-] = 1*10-8 б) [ОН-] = 1*10-6;
в) [ОН-] = 1*10-4; г) [ОН-] = 1*10-2.
1.6.44. Розрахувати концентрацію йонів водню у розчині сульфатної кислоти, якщо рН = 2. Навести розрахунки.
а) [H+] = 0,1; б) [H+] = 0,01;
в) [H+] = 0,2; г) [H+] = 0,02.
1.6.45. Визначити концентрацію йонів водню в слині, якщо рН=6,0. Навести розрахунок.
а) [H+] = 6,0; б) [H+] = 106;
в) [H+] = 10-6; г) [H+] = 1*106.
1.6.46. Розрахувати концентрацію [ОН-]-йонів у питній воді, якщо її рН = 6. Навести розрахунки.
а) [ОН-] = 0,003; б) [ОН-] = 1*10-6;
в) [ОН-] = 1*10-8; г) [ОН-] = 0,6.
1.6.47. Після тривалої роботи в гарячому цеху у робочого відмічено підвищення температури тіла до 38,5°С, тахікардія, порушення ритму сердечних скорочень. Переважно втрата якого електроліту призводить до порушення роботи серця?
а) калію; б) кальцію;
в) магнію; г) фосфору.
1.6.48. Ступінь дисоціації аміаку збільшується при:
а) Розведенні розчину;
б) Охолодженні розчину;
в) Концентруванні розчину;
г) Додаванні солі амонію;
1.6.49. Водневий показник 0,01 М розчину HCl дорівнює:
а) 2; б) 3; в) 5; г)4.
1.6.50. Водневий показник 0,001 Н розчину KOH дорівнює:
а) 11; б) 13; в) 10; г) 12
1.6.51. Водневий показник 0,01 Н розчину слабкої одноосновної кислоти (ступінь дисоціації 1%) дорівнює:
а) 4; б) 2; в) 1; г) 3
1.6.52. Водневий показник 0,001 М слабкої однокислотної основи (ступінь дисоціації 1%) дорівнює:
а) 9; б) 8; в) 10 г) 13
1.6.53. Водневий показник 0,05 М розчину H2SO4 дорівнює:
а) 1; б) 2; в) 5; г) 4
1.6.54. Водневий показник 0,001 М розчину хлоридної кислоти дорівнює:
а) 3; б) 0; в) 10; г) 7
1.6.55. Іонний добуток води – це:
а) сума концентрацій протонів та гідроксид-іонів;
б) добуток концентрацій протонів та гідроксид-іонів;
в) відношення концентрацій протонів та гідроксид-іонів.
1.6.56. За рН = 2 іонний добуток води дорівнює:
а) 10-2 моль/л; б) 10-14 моль/ л;
в) 10-12моль/л.
1.6.57. За рН = 11 іонний добуток води дорівнює:
а) 10-2 моль/л; б) 10-11 моль/ л;
в) 10-14 моль/л.
1.6.58. .Активна кислотність – це:
а) концентрація кислоти;
б) концентрація кислотного залишку;
в) концентрація протонів.
г) концентрація гідроксидних йонів
1.6.59. Потенціальна кислотність – це:
а) концентрація непродисоційованих молекул кислоти;
б) концентрація кислоти;
в) концентрація іонів гідрогену.
1.6.60. Загальна кислотність – це:
а) концентрація непродисоційованих молекул кислоти;
б) загальна концентрація кислоти;
в) концентрація протонів.
1.6.61. Титруванням визначають:
а) активну кислотність; б) потенціальну кислотність; в) загальну кислотність.
1.6.62. Формула обчислення рН розчину сильної кислоти:
а) рН = – lg Кд [кислоти]; б) рН = – lg [кислоти]; в) рН = – lgα – [кислоти].
1.6.63.Формула обчислення рН розчину слабкої кислоти:
а) pH =−lg Кд ⋅[кислоти] ;
б) рН = – lg [кислоти];
в) рН = – lg К д · [кислоти].
1.6.64.рОН – це:
а) натуральний логарифм концентрації лугу.
б) від’ємний десятковий логарифм концентрації гідроксид–іонів;
в) від’ємний десятковий логарифм концентрації основи.
1.6.65. Пепсин шлункового соку діє у:
а) кислому середовищі; б) лужному середовищі; в) нейтральному середовищі.
1.6.66 .рН венозної крові:
а) більший за рН артеріальної крові;
б) менший за рН артеріальної крові;
в) однаковий із рН артеріальної крові.
1.6.67. рН в клітині:
а) менший за рН крові; б) більший за рН крові; в) однаковий із рН крові.
1.6.68. .рН 0,001 М NaOH становить:
а) 3; б) 11; в) 6.
1.6.69. рОН 0,01М розчину КОН:
а) 12; б) 2; в) 7.
ГІДРОЛІЗ СОЛЕЙ
а) порушується рівновага дисоціації води, утворюється слабкий електроліт і, як правило, змінюється кислотність середовища; б) утворюються сильні електроліти, змінюється кислотність середовища; в) кислотність середовища не змінюється, утворюються сильні електроліти;БУФЕРНІ РОЗЧИНИ
а) постійність величини рН при розведенні або при додаванні невеликої кількості кислоти чи лугу; б) незначна зміна значення рН при додаванні невеликої кількості кислоти; в) зміна значення рН при розведенні;БУФЕРНА ЄМНІСТЬ.
а) визначається молярною масою еквівалента сильної кислоти, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю; б) визначається кількістю еквівалентів сильної кислоти або сильної основи, що… в) визначається молярною масою еквівалента сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився…КОЛІГАТИВНІ ВЛАСТИВОСТІ. ОСМОС
1.10.1. Дифузія – це процес: а) переміщення частинок речовини з зони більшої концентрації в меншу до… б) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації;Рівень
2.4. КОНЦЕНТРАЦІЇ РОЗЧИНІВ
2.4.1. Для приготування 100г розчину глюкози з масовою часткою 5% треба:
2.4.2. Для приготування 200г розчину гідрокарбонату натрію з масовою часткою 1,5 % потрібно:
2.4.3. Для приготування 400г розчину глюкози з масовою часткою 4,5% потрібно:
2.4.4. В 191 мл води розчинили 9 г глюкози. Розрахувати масову частку глюкози в розчині
2.4.5. Масова частка соляної кислоти в шлунковому соці рівна 0,5% (ρ=1,007г/см3) Яка молярна концентрація еквівалентів кислоти в шлунковому соці?
2.4.6. Яка маса кристалічної соди (Na2CO3* 10H2O) потрібна для приготування 250 мл розчину з молярною концентрацією 0,5 моль/л? Який титр приготованого розчину?
2.4.7. Для приготування 250 см3 розчину хлориду кальцію з молярною концентрацією 0,1 моль/дм3 потрібно:
2.4.8. Яка молярна концентрація еквівалентів солі в розчині, якщо в 400 мл розчину розчинено 8,1 г Na2CO3? Розрахувати масову частку даного розчину, якщо ρ=1,002 г/мл.
2.4.9. Яка масова частка хлориду кальцію в 0,2 М розчині CaCl2 (ρ=1,005г/см3) і титр цього розчину?
2.4.10. Яка маса хлориду Na потрібна для приготування 500 мл фізіологічного розчину (w=0,9%; ρ≈1 г/см3) Визначте полярність і титр розчину.
2.4.11. Який об’єм фізіологічного розчину (0,9 % NaCl, ρ= 1 г/мл) можна приготувати із 0,1 моля кухонної солі?
2.4.12. Для приготування 500 мл розчину сульфату алюмінію з молярною концентрацією еквівалентів солі 0,01 моль-екв/л потрібно:
2.4.13. Для приготування 200 мл розчину сульфату Купру му (ІІ) з молярною концентрацією еквівалентів 0,5 моль/л потрібно:
2.4.14 Для приготування 50 см3 розчину хлориду натрію з молярною концентрацією еквівалентів NaCl 0,143 моль-екв/л потрібно:
2.4.15. Встановити титр розчину, в 250 мл якого розчинено 3,6 г хлориду барію. Яка молярна концентрація еквівалентів солі в цьому розчині?
2.4.16. Яку масу калій перманганату необхідно взяти для приготування 200 мл 0,2 моль/л розчину?
2.4.17. Обчислити молярну концентрацію натрій хлориду с(NaCl) в розчині з масовою часткою натрій хлориду 10%, якщо густина розчину 1г/мл.
2.4.18. Молярна концентрація еквівалента натрій карбонату с(-Na2CO3)=0,1 моль/л. Обчислити масу карбонату натрію в 520мл розчину.
2.4.19. В 200мл розчину міститься 4,9г сульфатної кислоти. Розрахувати молярну концентрацію еквівалента сульфатної кислоти с(-H2SO4).
2.4.20. Обчислити масу води, яку необхідно додати до 50г розчину перманганату калію з масовою часткою перманганату калію 5%, щоб одержати розчин з масовою часткою перманганат калію 0,1%.
2.4.21. Молярна концентрація еквівалента сульфатної кислоти с(-H2SO4)=0,02моль/л. Розрахувати масову концентрацію сульфатної кислоти ρ(H2SO4).
2.4.22. До 50г спиртового розчину йоду з масовою часткою йоду 1% додали 2г йоду. Обчислити масову частку йоду в одержаному розчині.
2.5. ОСНОВИ ТИТРИМЕТРИЧНОГО АНАЛІЗУ
2.5.1. На титрування 20 мл розчину ацетатної кислоти моль/л. Розрахуйте молярну концентрацію еквівалента ацетатної кислоти у розчині:
2.5.2. Розрахуйте молярну концентрацію еквівалента калій гідроксиду в розчині, якщо на титрування 25 мл цього розчину витрачено 16,39 мл розчину сульфатної кислоти з молярною концентрацією еквівалента 0,02 моль/л:
2.5.3. Яка молярна концентрація еквівалента сульфатної кислоти в розчині, на титрування 10 мл якого витрачено 13,89 мл розчину кальцій гідроксиду з молярною концентрацією еквівалента 0,01 моль/л.
2.5.4. Розрахуйте молярну концентрацію еквівалента аміаку у 10 мл розчину, якщо на титрування цього розчину витрачено 9,79 мл розчину сульфатної кислоти з молярною концентрацією еквівалента 0,1 моль/л:
2.5.5. Яка молярна концентрація еквівалента сульфатної кислоти в 25 мл розчину на титрування якого витрачено 15,49 мл розчину калій гідроксиду з молярною концентрацією еквівалента 0,01 моль/л:
2.5.6. Розрахуйте молярну концентрацію еквівалента натрій гідроксиду в розчині об’ємом 100 мл, якщо на титрування 10 мл цього розчину витрачено 12,36 мл розчину хлоридної кислоти з молярною концентрацією еквівалента 0,01 моль/л:
2.5.7. Яка молярна концентрація еквівалента аміаку в 50 мл розчину, якщо на титрування 25 мл цього розчину витрачено 12,53 мл розчину хлоридної кислоти з молярною концентрацією еквівалента 0,01 моль/л:
2.5.8. Яка маса аміаку в 50 мл розчину, якщо на титрування цього розчину витрачено 19,23 мл розчину хлоридної кислоти з молярною концентрацією еквівалента 0,01 моль/л:
2.5.9. Розрахуйте масу натрій гідроксиду у розчині об’ємом 100 мл, якщо на титрування 10 мл цього розчину витрачено 12,36 мл розчину хлоридної кислоти з молярною концентрацією еквівалента 0,01 моль/л:
2.5.10. Розрахуйте масу калій гідроксиду у розчині, якщо на титрування 10 мл цього розчину витрачено 10,63 мл розчину сульфатної кислоти з молярною концентрацією еквівалента 0,02 моль/л:
2.5.11. Розрахуйте масу ацетатної кислоти у розчині об’ємом 50 мл, якщо на титрування 10 мл цього розчину витрачено 8,96 мл розчину натрій гідроксиду з молярною концентрацією еквівалента 0,005 моль/л:
2.5.12. Яка маса аміаку у 100 мл розчину, якщо на титрування 10 мл цього розчину витрачено 19,23 мл розчину хлоридної кислоти з молярною концентрацією еквівалента 0,1 моль/л:
2.5.13. Яка маса сульфатної кислоти у 25 мл розчину, на титрування якого витрачено 15,49 мл розчину барій гідроксиду з молярною концентрацією еквівалента 0,01 моль/л:
2.5.14. Розрахуйте масу калій гідроксиду, якщо на титрування 10мл цього розчину витрачено 10,63мл розчину сульфатної кислоти з молярною концентрацією 0,02моль/л.
2.5.15. За якою формулою обчислюють молярну концентрацію еквівалента барій гідроксиду згідно з даними титриметричного аналізу за реакцією Ba(OH)2 + 2HCl = BaCl2 + 2H2O?
2.5.16. Яка маса сульфатної кислоти у 25 мл розчину, на титрування якого витрачено 15.49 мл розчину барій гідроксиду з молярною концентрацією еквівалента 0,01 моль/л?
2.5.17. За якою формулою обчислюють масу хлоридної кислоти згідно з даними титриметричного аналізу за реакцією Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3?
2.5.18 Яка молярна концентрація еквівалента сульфатної кислоти у розчині, на титрування 10 мл якого витрачено 13.89 мл розчину кальцій гідроксиду з молярною концентрацією 0,01моль/л.
2.5.19. Розрахуйте молярну концентрацію еквівалента аміаку у 10 мл розчину, якщо на титрування цього розчину витрачено 9,79мл розчину сульфатної кислоти з молярною концентрацією 0,1 моль/л.
2.5.20. Розрахувати молярну концентрацію еквівалента розчину соляної кислоти, одержаного при змішуванні 1 об’єму 3,7 % її розчину (ρ=1,09 г/мл) і 3 об’ємів води.
2.5.21. При гіперацидному гастриті, язві шлунку призначають натрію гідрокарбонат в таблетках по ,3 г три рази на день після їди на протязі 10 днів. Розрахувати масу препарату необхідну на курс лікування.
2.5.16. При гіпертонічній хворобі І і ІІ ступеня призначають призначають внутрішньом’язево по 1 мл 0,5 % розчину девінкану щоденно на протязі 5 тижнів. Розрахувати масу препарату, необхідного для забезпечення курсу лікування.
2.5.22. При урологічних операціях призначають внутрішньо фурадонін по 0,15 г три рази в день. Курс лікування 8 днів. Розрахувати масу препарату, необхідного на курс лікування:
2.5.23. Який об’єм фізіологічного розчину (0,9 % NaCl, ρ= 1 г/мл) можна приготувати із 0,1 моля кухонної солі?
2.5.24. Для полоскання, спринцювання, а також промивання шлунку використовують 0,01 %-й розчин (ρ= 1 г/мл) калію перманганат. Розрахувати необхідного для приготування 2 л такого розчину.
2.5.25. Для лікування легеневих захворювань в медичній практиці використовують 10 %-й розчин йодиду калію. Яку кількість (масу КІ) необхідно взяти для приготування 2 кг такого розчину?
2.5.26. Розрахувати масу бури Na2B4O7 необхідну для приготування 500мл розчину з молярною концентрацією еквівалента рівною 0,02 моль/л.
2.5.30. При циститах, пієлітах призначають щоденне внутрішньовенне введення по 5 мл 40 %-го розчину гексаметилентетраміну (Мr = 140) напротязі 10 днів. Розрахувати молярну концентрацію препарату в розчині і його масу необхідну для курсового лікування.
2.6. КИСЛОТНО-ОСНОВНІ РІВНОВАГИ. рН.
2.6.1. Підрахувати концентрацію гідроксильних йонів у розчині, якщо рН цього розчину дорівнює 12. Навести розрахунки.
2.6.2. Підрахувати концентрацію водневих йонів у розчині, якщо рОН цього розчину дорівнює 12. Навести розрахунки.
2.6.3. Розрахувати рОН і рН розчину в якому концентрація гідроксильних йонів дорівнює 1*10-5 моль/л. Навести розрахунки і вказати середовище.
2.6.4. Розрахувати рН у розчині фосфатної кислоти, якщо СН+=0,02 моль/л.
2.6.5. Молярна концентрація іонів гідрогену сечі дорівнює 3,16*10-6 моль-л. Чому дорівнює рОН?
2.6.6. Молярна концентрація йонів гідроксиду артеріальної крові дорівнює молярній концентрації іонів гідрогену (моль/л):
а) 8*10-5; б) 4*10-6; в) 6*10-7; г) 4*10-9.
2.6.7. Активна кислотність шлункового соку дорівнює 0,047. Розрахувати рН.
а) рН = 1,05; б) рН = 1,33;
в) рН = 2,66; г) рН = 4,7.
2.6.8. Розрахувати рОН розчину гідроксиду амонію з концентрацією 0,2 моль/л, якщо ступінь дисоціації α=0,042.
2.6.9. Розрахувати рН 0,1 М розчину гідроксиду амонію, ступінь дисоціації якого дорівнює 0,1. Навести розрахунки.
2.6.10. Підрахувати рН розчину гідроксиду амонію, концентрація якого 0,04 моль/л, якщо К(NH4OH) = 1,8*10-5. Навести розрахунки.
2.6.11. Розрахувати рН 0,1 М розчину гідроксиду амонію, якщо константа дисоціації К(NH4OH) = 1,8*10-5. Навести розрахунки.
2.6.12. Розрахувати рН у розчині гідроксиду амонію з концентрацією 0,01 моль/л, якщо К(NH4OH) = 1,79*10-5. Навести розрахунки.
2.6.13. Розрахувати рН одномолярного розчину NH4OH, константа дисоціації якого К(NH4OH) = 1,8*10-5. Навести розрахунки.
2.6.14. Розрахувати рН розчину NH4OH з концентрацією ω=2,5 %, якщо ступінь дисоціації дорівнює 0,135. Навести розрахунки.
а) рН=9,30; б) рН=10,92
в) рН=12,98 г) рН=13,02.
2.6.15. Розрахувати рН 0,001 М розчину оцтової кислоти, ступінь дисоціації якої дорівнює 0,1. Навести розрахунки.
2.6.16. Розрахувати рН 0,001 М розчину оцтової кислоти, константа дисоціації якої дорівнює Кд = 1,8*10-5. Навести розрахунки.
2.6.17. Розрахувати рН у розчині оцтової кислоти (Кд = 1,8*10-5), концентрація якої 0,009 моль/л, якщо. Навести розрахунки.
2.6.18. Розрахувати рН розчину мурашиної кислоти з масовою часткою 5%, якщо К(НСООН)=1,8*10-4, ρ=1г/мл. Навести розрахунки.
а) рН=2,58; б) рН=2,78; в) рН=0,92; г) рН=1,86.
2.6.19. Молярна концентрація розчину оцтової кислоти с(СH3СООН)=0,01 моль/л, ступінь дисоціації електроліту 100%. Визначити рН розчину, враховуючи, що ступінь дисоціації електроліту 1,3%:
а) 3,68; б) 3,43; в) 2,89; г) 3,89.
2.6.20. Обчислити рОН розчину карбонатної кислоти з молярною концентрацією еквівалента 0,00001 моль/л, якщо Кд = 4,5*10-7. Навести розрахунки.
2.6.21. Розрахувати рН у розчині молочної кислоти (Кд=1,44*10-4), концентрація якої 0,009 моль/л. Навести розрахунки.
2.6.22. Молярна концентрація розчину хлоридної кислоти с(HCl)=0,05 моль/л, ступінь дисоціації електроліту 100%. Визначити рОН розчину при умові, що його розбавили в 2 рази:
а) 12,7; б) 12,6; в) 12,4; г) 11,7.
2.6.23. У 300 мл води розчинили 0,3 г молочної кислоти (Мч=90) Розрахувати рН цього розчину, якщо константа дисоціації молочної кислоти дорівнює 1,44*10-4. Навести розрахунки.
а) рН=1,44; б) рН=2,9
в) рН=4,35 г) рН=3,85.
2.6.24. Є дві проби шлункового соку. В одній з них вміст соляної кислоти складає 0,1 %, у другій – 0,2 %. У якій пробі величина рН буде більшою? Навести розрахунки.
2.6.25. Є розчини соляної та оцтової кислот з однаковою молярною концентрацією 0,01 моль/л. У якому розчині значення рН буде більшим? Навести розрахунки, приймаючи до уваги що КСН3СООН = 1,8*10-5.
2.6.26. Є розчини соляної та оцтової кислот з однаковою молярною концентрацією 0,1. У якому розчині рН буде більшим, коли константа дисоціації оцтової кислоти дорівнює 1,8*10-5. Навести розрахунки.
2.6.27. Розрахувати концентрацію йонів водню у шлунковому соці, якщо рН=1,2. Навести розрахунки.
а) [H+] = 6,31*10-2; б) [H+] = 9,03*10-3;
в) [H+] = 3,07*10-3; г) [H+] = 0,63
2.6.28. Розрахувати молярну концентрацію оцтової кислоти в розчині, якщо рН =2,79, а ступінь дисоціації α = 0,135. Навести розрахунки.
а) 0,012 моль/л; б) 0,017 моль/л;
в) 0,022 моль/л; г) 0,031 моль/л;
2.6.29. Розрахувати молярну концентрацію оцтової кислоти в розчині, якщо рН = 4,2, а константа дисоціації КСН3СООН = 1,8*10-5.
а) 0,22*10-3 моль/л; б) 0,11*10-3 моль/л;
в) 0,44*10-3 моль/л; г) 0,33*10-2 моль/л;
2.6.30. рН секрету підшлункової залози дорівнює 8,5. Чому дорівнює молярна концентрація іонів гідрогену (моль/л)
а) 3,16*10-6; б) 4,16*10-7;
в) 5,16*10-8; г) 3,28*10-10.
2.6.31. Розрахувати масу КОН, яка необхідна для приготування 1 л водного розчину з рН=12,5 (густина розчину ρ=1 г/мл)
а) 0,77г; б) 1,77г; в) 2,54г; г) 0,254г.
2.6.32. Яку масу КОН та води необхідно взяти для приготування 1 л розчину з рН=13,2 (ρ=1 г/мл) Навести розрахунки.
а) 8,85г і 991,15 г; б) 0,885 г і 999,115 г;
в) 4,42 г і 995,58 г; г) 0,442 г і 999,558 г.
2.6.33. Скільки грамів КОН необхідно взяти для приготування 200 мл розчину (ρ=1г/мл) з рН=11,9. Навести розрахунки.
а) 0,089г; б) 0,890;
в) 0,0445 г; г) 0,445 г.
2.6.34. Скільки грамів NaOH необхідно взяти для приготування 250 мл водного розчину з рН=12 (ρ=1 г/мл) Навести розрахунки.
а) 0,01г; б) 0,1г; в) 1,0г; г) 4,0г.
2.6.35. Водневий показник розчину кальцій гідроксиду 10. Визначити масу Са(ОН)2 в грамах в 200 мл розчину, враховуючи, що ступінь дисоціації електроліту 100%:
а) 4,2*10-2; б) 3,4*10-3;
в) 1,2*10-5; г) 8,6*10-4.
2.6.36. Молярна концентрація розчину сульфатної кислоти с(H2SO4)=0,05моль/л. Визначити рОН розчину, враховуючи , що ступінь дисоціації електроліту 100%.
2.6.37. Молярна концентрація іонів гідрогену шлункового соку дорівнює 10-2 моль/л. Чому дорівнює рОН?
2.6.38. Молярна концентрація розчину оцтової кислоти с(СН3СООН)=0,01 моль/л. Визначити рН розчину, враховуючи, що ступінь дисоціації електроліту 1,3%.
2.6.39. Молярна концентрація іонів гідрогену артеріальної крові дорівнює 4,0·10-8 моль/л. Чому дорівнює молярна концентрація іонів гідроксилу?
2.6.40. Молярна концентрація розчину кальцій гідроксиду с(Са(ОН)2)=0,005 моль/л. Визначити рН розчину, враховуючи, що ступінь дисоціації електроліту 100%.
2.6.41. рН секрету підшлункової залози дорівнює 8,5. Чому дорівнює молярна концентрація іонів гідроксиду рОн?
2.6.42. Молярна концентрація розчину натрій гідроксиду с(NaОН)=0,01моль/л, ступінь дисоціації електроліту 100%. Як зміниться рН розчину при розведенні його в 100 разів?
2.6.43. Молярна концентрація іонів гідроксилу шлункового соку дорівнює 10-12 моль/л. Чому дорівнює рН?
2.6.44. Молярна концентрація розчину хлоридної кислоти с(НCl)=0,05 моль/л, ступінь дисоціації електроліту 100%. Визначити рОН розчину при умові, що його розбавили в 2 рази.
2.6.45. рН підшлункового соку дорівнює 2. Розрахувати с(Н+), с(ОН-), а також рН його при розведенні в 10 та 100 разів.
ГІДРОЛІЗ СОЛЕЙ
2.7.1. Написати іонне та молекулярне рівняння першої стадії гідролізу натрій карбонату. 2.7.2. Написати іонне та молекулярне рівняння першої стадії гідролізу натрій фосфату.БУФЕРНІ РОЗЧИНИ
Як зміниться рН даного аміачного буферу при доливанні до нього 20 мл розчину кислоти з молярною концентрацією еквівалентів 0,1 моль/л. 2.8.2. Аміачна буферна система складається з 100 мл розчину гідроксиду амонію з молярною концентрацією еквівалентів…БУФЕРНА ЄМНІСТЬ
3.9.2. До 50 мл крові для зміни рН від 4,5 до 6,2 треба додати 10 мл розчину…КОЛІГАТИВНІ ВЛАСТИВОСТІ. ОСМОС
2.10.2. 1 літр розчину містить 18,4 г гліцерину. Осмотичний тиск такого…СИТУАЦІЙНІ ЗАДАЧІ
3.1. При клінічному дослідженні шлункового соку визначено його рН= 0,8. Розрахувати: 1) Дане значення рН для шлункового соку відповідає за кислотність: а) понижену; б) підвищену;– Конец работы –
Используемые теги: медичної, хімії, Комплексоутворення, біологічних, системах0.091
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: З медичної хімії Комплексоутворення в біологічних системах
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов