БУФЕРНА ЄМНІСТЬ.
1.9.1. Буферна ємність це розрахункова величина:
а) визначається молярною масою еквівалента сильної кислоти, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
б) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
в) визначається молярною масою еквівалента сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
г) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН залишився сталим.
1.9.2. На буферну ємність розчинів впливають:
а) константа дисоціації і температура;
б) співвідношення концентрації компонентів і тиск;
в) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину;
г) константа дисоціації і природа буферного розчину.
1.9.3.На буферну ємкість розчинів впливають:
а) константа дисоціації і природа буферного розчину;
б) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину.
в) співвідношення концентрації компонентів і тиск;
г) константа дисоціації і температури.
1.9.4. На скільки одиниць змінюється рН буферного розчину при розрахунку його буферної ємності:
а) 1; б) 2; в) 3; г) 0,5.
1.9.5. Буферну ємність розраховують за об’ємом буферного розчину:
а) 1 дм3; б) 1 см3; в) 1 м3; г) 1 мл.
1.9.6. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти;
в) більше основи; г) менше основи;
д) однакові.
1.9.7. Найбільшу буферну ємність за кислотою має буферний розчин, в якому співвідношення кислоти і солі є:
а) більше кислоти; б) більше солі;
в) однаково; г) менше кислоти.
1.9.8. Розрахунок буферної ємності можна провести за:
а) кислотою і водою; б) кислотою і сіллю;
в) кислотою і основою; г) основою і сіллю.
1.9.9. Величину буферної ємності за кислотою розраховують:
а) 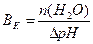 ; б)
; б) 
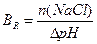 ;
;
в) 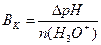 ; г)
; г) 
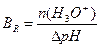 .
.
1.9.10. Величину буферної ємності за основою розраховують:
а)  ; б)
; б) 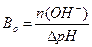 ;
;
в) 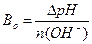 ; г)
; г)  .
.
1.9.11. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти; в) однакові; г) менше основи; д) більше основи.
1.9.12. У плазмі крові найбільшу роль відіграють буферні системи:
а) аміачна; б) гідрокарбонатна;
в) ацетатна; г) гемоглобінна.
1.9.13. У плазмі крові найбільшу роль відіграють буферні системи:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.14. У еритроцитах переважає буферна система:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.15. Які функціональні групи білкових молекул зумовлюють їх буферну дію?
а) –СООН; -NO2; б) –СООН; -NН2;
в) -NН2; -CN; г) -NН2; -NO2.
1.9.16.Механізм дії буферних систем направлений на:
а) нейтралізацію кислих і лужних продуктів;
б) відновлення кислих і лужних продуктів;
в) гідроліз кислих і лужних продуктів;
г) окиснення кислих і лужних речовин.
1.9.17. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти:
а) гідроліз, протоліз, нейтралізація;
б) окислення, гідроліз, протоліз;
в) електролітична дисоціація, протоліз, нейтралізація;
г) електролітична дисоціація, протоліз, гідроліз.
1.9.18. Механізм дії гідрокарбонатної буферної системипри надходженні лужних продуктів представлений рівнянням:
а) Н3О+ + НСО3- ↔ Н2СО3 + Н2О
б) Н3О+ + ОН- ↔ 2 Н2О
в) Н2СО3 + ОН- ↔ НСО3- + Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.19. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) Н3О+ + ОН- ↔ 2Н2О
б) Н2СО3 + ОН- ↔ НСО3- + Н2О
в) Н3О+ + НСО3-↔ 2 Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.20. Кислотно-основна рівновага крові визначається:
а) величиною рН, концентрацією йонів НСО3-, тиском СО2 в крові;
б) величиною рН, концентрацією йонів ОН-, тиском СО2 в крові;
в) величиною рН, температурою, концентрацією йонів ОН-;
г) концентрацією йонів Н3О; ОН-, температурою.
1.9.21. Лужний резерв крові вимірюється:
а) об’ємом СО2; б) об’ємом СО;
в) Об’ємом НО2; г) Об’ємом NО2.
1.9.22. При якому співвідношенні НСО3-:Н2СО3 рН гідрокарбонатного буферу відповідає рН крові:
а) 20:1; б) 15:1; в) 1:1; г) 1:20.
1.9.23. Механізм дії буферної системи оксигемоглобін-гемоглобін при надходженні кислих продуктів представлений рівнянням:
а) ННb + OH- ↔ Hb- + H2O
HHbO2 + OH- ↔ HbO2- + H2O;
б) Hb- + H3O+ ↔ ННb + H2O
HbO2- + H3O+ ↔ HHbO2 + H2O;
в) Hb- + H2O ↔ ННb + OH-
HbO2- + H2O ↔ HHbO2 + OH-;
г) Hb- + Н2СО3 ↔ HHbO2 + НСО3-
HbO2- + Н2СО3 ↔ HHbO2 + НСО3-.
1.9.24. Буферна система оксигемоглобін-гемоглобін характеризується рівновагою між йонами:
а) Hb- і ННb б) Hb- і OH-
HbO2- і HHbO2; HbO2- і OH-;
в) Hb- і H3O+ г) Hb- і HHbO2
HbO2- і H3O+; HbO2- і ННb.
1.9.29. Значення рН плазми крові в нормі може знаходитись:
а) 7,35-7,45; б) 6,80-7,0;
в) 7,15-7,35; г) 8,01-8,35.
1.9.30. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) називають:
а) алкалозом; б) анабіозом;
в) ацидозом; г) антагонізмом.
1.9.31. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) називають:
а) ацидозом; б) алкалозом;
в) анабіозом; г) антагонізмом.
1.9.32. Яку із наведених речовин можна використовувати для коригування кислотно-основного стану організму при ацидозі:
а) NaHCO3; б) NaCl
в) HCl г) аскорбінову кислоту.
1.9.33. Механізм дії білкової буферної системи при надходженні кислих продуктів представлений рівняням:
а) 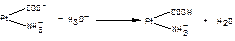 ;
;
б) 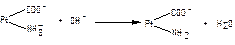 ;
;
в) 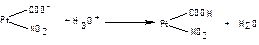 ;
;
г)  ;
;
1.9.34. Механізм дії на фосфатну буферну систему кислотою представлений рівнянням:
а) НРО4-2 + Н2О ↔ Н2РО4- + ОН-;
б) Н2РО4- + ОН- ↔ НРО4-2 + Н2О;
в) НРО4-2 + Н3О ↔ Н3РО4 + ОН-;
г) НРО4-2 + Н3О ↔ Н2РО4- + Н2О.
1.9.35.Буферна ємкість – це кількість моль екв. сильної кислоти або лугу, яку необхідно додати до:
а) 1мл буферної системи, щоб змінити рН на 1;
б) 10л буферної системи, щоб змінити рН на 1;
в) 1л буферної системи, щоб змінити рН на 1.
1.9.36.Буферна ємкість – це кількість моль екв. сильної кислотабо лугу, яку необхідно додати до 1л буферної системи, щоб змінити рН на:
а) 2; б) 1; в) 10.
HHbO2 + OH- ↔ HbO2- + H2O