Уравнение Кирхгофа

Уравнение Кирхгофа
. .. т …. . 11∆r H0T = ∆r H0298 + ∫ ∆r С0p dT! ! . .. 298 .. .Задача Для химической реакции
С(к) + СО2, (г) = 2СО(г)
Рассчитать ∆rН0298 , ∆rН01000 считая постоянными теплоемкости реагентов в данном температурном интервале.
Решение
∆rН0Т = ∆rН0298 + ∆rС0р(Т - 298)
По табличным данным находим:
Вещество: Δf Н0298,кДж/моль С0р 298 ,Дж/моль.К
С(графит) 0 8,54
СО2 (г) -393,5 37,41
СО (г) -110,5 29,14
Δr Н0298 = 2Δf Н0298 СОг - Δf Н0298 Ск - Δf Н0298 СО2г =
КДж.
R Н0298 > 0 - реакция эндотермическая.
Изменение теплоемкости системы (∆ rС0р = const):
∆r С0 р= 2С0р 298Сог – С0р 298Ск – С0р 298СО2г =
Дж/К
R Н01000 = 172,5 + 12,33.10-3.(1000 - 298) = 181,16 кДж.
(При расчетах соблюдайте размерность!)
Вывод: При изменении температуры на 702К увеличение теплового эффекта составляет ≈ 5% → влияние температуры на тепловой эффект небольшое
 |
Задача. Для химической реакции
С(к) + СО2(г) = 2СО(г)
Рассчитать ∆r S0Т при 298К и при 1000К, считая Сp(i) = const в рассматриваемом температурном интервале.
Решение.
Вещество S0298,Дж/(моль.K) С0р298,Дж/(моль.К)
С(графит) 5,74 8,54
СО2 (г) 213,68 37,41
СО (г) 197,54 29,14
Δr S0298 = 2S0298,СО(г) - S0298,С(к) - S0298,СО2(г) =
Дж/K.
∆rС0р = 2С0р 298СО(г) – С0р 298 С(к) – С0р 298 СО2(г) =
Дж/К.
∆r S01000 = ∆r S0298 + ∆r С0р ln ( Т / 298) =
Ln(1000/298) = 175,66+14,93 = 190,59Дж/К
(обратите внимание на размерность!)
Вывод: при DT = 702К Þ Dr S 0 ≈ 8,5%.
Влияние температуры на энтропию процесса для многих реакций не велико.
Зависимость ∆rG 0= f(T) от температуры: ∆r G0Т =… Приближения:.
* Если считать ∆r С0р= 0 (теплоемкость системы не меняется при прохождении реакции) Þ
≈.∆r G0T = ∆rH0298 - TDr S0298. .
Зависимость ∆rGТ = f(p) от давления :
: : Связь между ΔrGT и∆rG0T выражается уравнением изотермы Вант - Гоффа : :
для реакции aA(г) + bB(г) + dD(к) = eE(г) + fF(г)
 газ. прод.
газ. прод.
Газ. исх.
=p кПа/101 кПа; = p Па/105 Па;P мм.рт.ст./760 мм.рт.ст.
: :Внимание! В уравнение входят только относительные парциальные давления газообразных веществ (вещество D(к) учитывается только при расчете… Если относительные парциальные давления всех газов = 1 (стандартное…Примеры решения задач
Задача. Определите возможность самопроизвольного протекания реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и 1000 К и стандартных состояниях всех компонентов (∆r H0T и ∆r S0T - не зависят от температуры, ≈ Соnst ). Т.е. ∆r H0298 = 172,5 кДж,
∆r S0298 =175,66 Дж/К. (см. предыдущие примеры)
Решение. Возможность самопроизвольного протекания реакции определяется неравенством ∆r G0T < 0
∆rG0Т = ∆rH0Т - T∆rS0Т ≈ ∆rH0298 - T∆rS0298
RG0298 = 172,5 – 298.175,66.10-3 = 120,15 кДж > 0 - реакция в прямом направлении невозможна .
∆rG01000 = 172,5 – 1000.175,66.10-3 = - 3,16 кДж < 0 - реакция в прямом направлении возможна.
Задача. Определить температурную область самопроизвольного протекания реакции
С(к) + СО2(г) = 2СО(г)
При стандартных состояниях компонентов.
Решение. Возможность самопроизвольного протекания реакции определяется неравенством ∆r G0T < 0
т.е. , если:
R G0Т = ∆r H0298 +∆r С0pdT - Т∆r S0298- Т ∆r С0p/T)dT < 0
Если ∆rH0 и ∆rS0 не зависят от температуры:
R G0Т ≈ ∆r H0298 - T∆r S0298 < 0.
∆r G0Т = (172,5 – Т . 175,66.10-3) < 0(размерность!)
Решаем неравенство Þ Т > 982 К
Из справочных данных: í СО (г) 298 – 2500К
Iacute; С(графит) 298 – 2300К
Iacute; СО2 (г) 298 – 2500К
Следовательно, искомая область температур: 982÷2300К
∆rG0ТЗадача. При каком соотношении парциальных давлений газообразных компонентов реакции
С(к) + СО2(г) = 2СО(г)
При 298К возможно ее протекание в прямом направлении?
Решение. Возможность самопроизвольного протекания реакции определяется неравенством ∆r GT < 0.
По уравнению изотермы Вант-Гоффа:
RG298 = ∆rG0298 + RT ln < 0.
R G298 = 120,15 + 8,31.10-3.298 ln< 0
Решаем неравенство Þ ln < - 48,5
решаем Þ 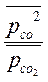 < 10 -21
< 10 -21
THORN; для того, чтобы при 298К реакция протекала
в прямом направлении, должно быть:
РСО < рСО2 ≈ в 1010 раз.
Реакция горения газового топлива в общем виде:Значения стандартной теплоты сгорания 1 моля топлива Δ Н0сг , [кДж/моль] при стандартном состоянии ( р =101кПа) сведены в таблицы.
Расчет стандартной теплоты сгорания Δ Н0сг Þ по следствию из закона Гесса
С использованием табличных данных теплоты образования компонентов, рассчитаем:КДж/мольСН4.
Δ Н0сг С2Н5ОН = 2Δf Н0СО2 + 3Δf Н0Н2О - Δf Н0С2Н5ОН - 3Δf Н0О2 =
КДж/моль
С2Н5ОН.
В технике термохимические свойства топлива характеризуются его удельной теплотой сгорания QТ

Удельная теплота сгорания QТ
жидкого и твердого топлива:
Q T = - ( DНсг . 1000 / М ) , кДж/кг,
Где М - молярная масса топлива, г/моль.
Удельная теплота сгорания QТ
газового топлива:
Q T = - ( DНсг . 1000 / 22,4 ) , кДж/м3 ,
Где 22,4 л/моль – молярный объем газа при н.у.
Для этанола:
Q T = - ( -1234,7 . 1000 / 46) = 26841,3 кДж/кг
Для метана:
Q T = - ( -802,28 . 1000 / 22,4) = 35816,1 кДж/м 3
Чем выше теплота сгорания топлива, тем больше его энергетическая ценность.