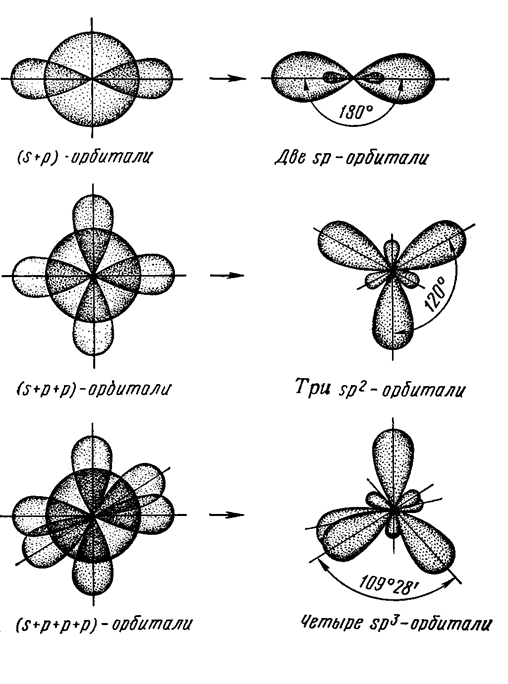
Теория гибридизации.

Основные положения теории гибридизации:
1. Происходит смешивание орбиталей различных подуровней с образованием новых (гибридных) орбиталей, промежуточных по форме и энергии.

2. Химические связи, образованные гибридными орбиталями, обладают большей прочностью, чем связи, образованные негибридными.
3. Число гибридных орбиталей всегда равно числу смешивающихся орбиталей.
4. Тип гибридизации определяется типом и количеством смешивающихся орбиталей (sp-, sp2-, sp3-, dsp2-, dsp3 ).
5. Связи направлены симметрично, образующиеся молекулы неполярны.
Характеристики гибридных орбиталей.
| Тип гибридизации | Угол между связями, град | Примеры молекул | Форма молекул |
| sp | BeCl2 (IIА) | Линейная | |
| sp2 | BF3 (IIIА) | Правильный треугольник | |
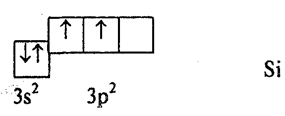
| sp3 | 109º28´ | SiCl4 (IVА) | Тетраэдр |
| dsp2 | [AuCl4]– | Квадрат | |
| sp3d1 | 90 и 120 | РCl5 (VА) | Тригональная бипирамида |
| sp3d2 | SF6 (VIА) | Октаэдр |