Типы управляемых каналов и насосы
1)
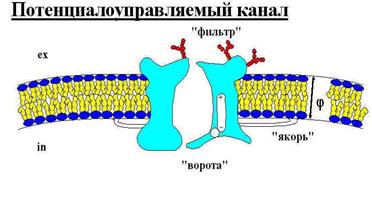
«Ворота» канала системой «рычагов» соединены с диполем, который может поворачиваться, открывая или закрывая ворота. «якорные части» фиксируют положение белка в мембране (в незакреплённом состоянии белок способен совершать латеральное движение по мембране.
2)

На белок садится некий интермедиат, меняя его конформацию, вследствие чего канал открывается. После отделения интермедиата от белка, канал закрывается.
3)

Состоят из нескольких белковых фракций. На R-белок садится некое вещество (например гормон), вызывая конформационные изменения этого белка. R-белок «мехаически» взаимодействует с G-белком, который , в свою очередь, взаимодействует с С-белком. С-белок осуществляет реакцию АТФ ® цАМФ + 2Ф и активизирует протеинкиназу, присоединяя Ф к белку-каналу, после чего канал открывается.
Na+,K+-насос или Na+,K+-АТФаза
Натриево-калиевые насосы, имеющиеся в плазматических мембранах всех животных клеток, работают по принципу антипорта, активно выкачивая катионы Na+ из клетки, а K+- в клетку против градиентов их концентраций (а в случае Na+ и против электрического градиента).
Градиенты концентраций ионов Na+ и K+, поддерживаемые Na+,K+- насосом, ответственны в клетке не только за ее мембранный потенциал (цитоплазма клетки заряжена отрицательно по отношению к внешнеклеточному пространству), но и за регуляцию клеточного объема (явление осмоса), а также за активный транспорт сахаров и аминокислот по механизму симпорта.
Механизм работы Na+,K+-насоса. Экспериментально установлено и доказано, что источником энергии для работы Na+,K+-насоса служит гидролиз АТФ. Na+,K+-насос представляет собой фермент - Na+,K+-АТФ-азу. Этот фермент состоит из 2-х субъединиц: трансмембранной, обладающей каталитической активностью (100000 Д), и ассоциированного с ней гликопротеина (45000 Д). Каталитическая субъединица имеет участки связывания на наружной поверхности цитоплазмы для ионов Na+ и АТФ, а на внутренней – для ионов K+ и ингибитора фермента – уабаина. Функция гликопротеина остается пока невыясненной. Установлено, что работа Na+,K+-насоса происходит следующим образом:
- Концевая фосфатная группа АТФ в присутствии ионов Na+ переносится на остаток аспарагиновой кислоты в молекуле фермента Na+,K+-АТФ-азы. Na+-зависимое фосфорилирование, вероятно, изменяет конформацию АТФ-азы, что каким-то образом приводит к выведению катионов Na+ из клетки.
- Связавшаяся с ферментом фосфатная группа затем гидролизуется в присутствии ионов K+ (именно этот процесс ингибируется уабаином).
- K+-зависимое дефосфорилирование, вероятно, обусловливает транспорт K+ внутрь клетки и возвращение АТФ-азы в первоначальное состояние. Работающий Na+,K+-насос можно воссоздать из очищенного фермента АТФ-азы. Для этого АТФ-азу солюбилизируют в избытке детергента, подвергают очистке и смешивают с соответствующими фосфолипидами. После удаления детергента диализом образуются мембранные пузырьки, которые в присутствии АТФ и Mg2+ перекачивают катионы Na+и K+ в противоположных направлениях.
Таким образом, биологическая функция Na+,K+-насоса состоит в гидролитическом расщеплении АТФ и использовании высвобождающейся при этом свободной энергии для перекачивания ионов K+ из окружающей среды внутрь клетки, а ионов Na+ - из клетки во внешнеклеточное пространство. В различных клеточных мембранах важную роль играют АТФ-азы,
транспортирующие другие катионы (Н+, Са2+).
Н+-АТФ-синтетазы. В плазматических мембранах аэробных бакте-
рий и во внутренних мембранах митохондрий и хлоропластов эукариотических клеток присутствуют ферменты АТФ-синтетазы, которые катализируют синтез АТФ из АДФ и фосфата. Этот процесс осуществляется благодаря наличию на этих мембранах градиента концентраций протонов.

Рис 5.5 - Схематическое изображение работы фермента Na+,K+-АТФ-азы
Градиент концентраций H+ возникает на отдельных этапах транспорта электронов в процессе окислительного фосфорилирования у бактерий и в митохондриях высших организмов или фотосинтеза в хлоропластах растений, а также с помощью фотоактивируемого протонного насоса (бактериородопсина) у Halobacterium.