Принцип Паули
Мы установили, что состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
главным n (n = 1, 2, 3, …),
орбитальным l (l = 0, 1, 2, …, n –1),
магнитным m (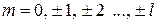 ),
),
спиновым ms (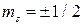 ).
).
В основном состоянии атома (n = 1) все электроны должны были бы находиться в 1s-состоянии. Однако на самом деле это не так. Швейцарский физик-теоретик Вольфгант Паули установил в 1925 г. квантово-механический закон, названный впоследствии принципом Паули:
в любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных состояниях, определяемых набором четырех квантовых числе: главного n, орбитального l, магнитного m и спинового ms.
Согласно принципу Паули можем написать
| n = 1 l = 0 m = 0 ms = +1/2 ms = –1/2 | В состоянии n = 1 могут находиться только 2 электрона (с l = 0 имеем 2 электрона) |
| n = 2 l = 0 m = 0 ms = +1/2 ms = –1/2 l = 1 m = 0 ms = +1/2 ms = –1/2 m = +1 ms = +1/2 ms = –1/2 m = –1 ms = +1/2 ms = –1/2 | В состоянии n = 2 могут находиться только 8 электронов (с l = 0 имеем 2 электрона, с l = 1 имеем 6 электронов) |
Продолжая рассуждение, получим следующую закономерность: в состоянии n могут находиться только 2n2 электронов, причем максимальное число электронов, соответствующих квантовому числу l, равно 2(2l +1).
Принцип Паули сыграл выдающуюся роль в развитии современной атомной и ядерной физики. Так, например, удалось теоретически обосновать периодическую систему элементов Менделеева. Теория периодической системы основывается на следующих положениях:
1) порядковый номер химического элемента равен общему числу электронов в атоме данного элемента;
2) состояние электронов в атоме определяется набором их квантовых чисел n, l, m, ms. Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией;
3) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
Электроны в атоме, занимающие совокупность состояний с одинаковым значением главного квантового числа n, образуют электронный слой. В зависимости от значений n различают следующие слои:
K при n = 1,
L при n = 2,
M при n = 3,
N при n = 4 и т. д.
Из формулы 2n2 определяют максимальное число электронов, которые могут находиться в слоях. Например, в K слое находится 2 электрона, в L, M, N слоях — соответственно 8, 18 и 32 электрона.
В каждом из слоев электроны распределяются по оболочкам, каждая из которых соответствует определенному значению орбитального квантового числа l. Максимальное число электронов, находящихся в состоянии, определяемом значением l орбитального квантового числа, дается формулой 2(2l +1) (табл. 87.1).
Таблица 87.1
| Слой | Число электронов в состояниях | Макс. число электронов | |||
| s (l = 0) | p (l = 1) | d (l = 2) | f (l = 3) | ||
| K | |||||
| L | |||||
| M | |||||
| N |
В атомной физике принято обозначать электронное состояние в атоме символом nl, указывающим значения двух квантовых чисел. Электроны, находящиеся в состояниях, характеризуемых одинаковыми квантовыми числами n и l, называют эквивалентными. Число z эквивалентных электронов указывается показателем степени в символе nlz.
Если электроны находятся в некоторых состояниях с определенными значениями квантовых чисел n и l, то считается заданной электронная конфигурация. Например, основное состояние атома кислорода можно выразить следующей символической формулой

Она показывает, что два электрона находятся в состояниях с n = 1 и l = 0, два электрона — c n = 2 и l = 0 и четыре электрона — с n = 2 и l = 1.