Квантование водородоподобного атома в сферически-симметричном поле.
Рассмотрим систему, состоящую из неподвижного ядра с зарядом Ze и движущегося вокруг него электрона. При Z=1 это атом водорода, при Z> 1 это водородоподобный атом. Потенциальная энергия электрона равна U= 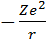 . Следовательно уравнение Шрёдингера имеет вид
. Следовательно уравнение Шрёдингера имеет вид 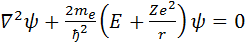 . Т.к. электрон движется в сферически-симметричном поле, перейдём к сферическим координатам и раскроем оператор Лапласса. Получим выражение
. Т.к. электрон движется в сферически-симметричном поле, перейдём к сферическим координатам и раскроем оператор Лапласса. Получим выражение 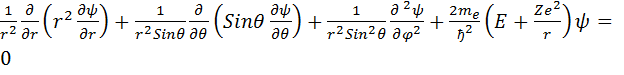
Это уравнение имеет конечные, непрерывные значения при любых E>0 и при дискретных отрицательных E равных 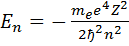 Случай E>0 соответствует электрону, пролетающему вблизи ядра и удаляющемуся снова на бесконечность, E<0 соответствует электрону, связанному с ядром.
Случай E>0 соответствует электрону, пролетающему вблизи ядра и удаляющемуся снова на бесконечность, E<0 соответствует электрону, связанному с ядром.
14. Орбитальное, магнитное, главное и спиновое квантовые числа.
n – главное квантовое число, совпадает с номером уровня энергии, принимает значения 1,2,3, … l – азимутальное квантовое число. При заданном n принимает значения 0,1,2,…,n-1 (т.е. может принимать n различных значений). m – магнитное квантовое число, при данном l может принимать 2l+1 различных значений m= 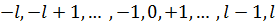
s – спиновое число, принимает значения -1/2, 1/2.
15. Полное число квантовых состояний.
Согласно 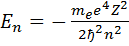 энергия зависит только от главного квантового числа. Следовательно, каждому собственному значению энергии
энергия зависит только от главного квантового числа. Следовательно, каждому собственному значению энергии 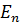 соответствует несколько собственных функций, различающихся квантовыми значениями l и m. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в различных состояниях. Каждому из n значений квантового числа l соответствует 2l+1 значений m. Следовательно различных состояний соответствующих n равно
соответствует несколько собственных функций, различающихся квантовыми значениями l и m. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в различных состояниях. Каждому из n значений квантового числа l соответствует 2l+1 значений m. Следовательно различных состояний соответствующих n равно 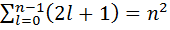 т.е. n в квадрате. Состояния с различными значениями азимутального квантового числа l различаются значениями момента импульса. Электрон находящийся в состоянии с l=0 называют s-электрон, с l=1 – p – электрон, 2 – d – электрон, 3 – f – электрон. Значение квантового числа ставится перед обозначением азимутального, т.е. электрон с n=3 и l=1 это 3s электрон.
т.е. n в квадрате. Состояния с различными значениями азимутального квантового числа l различаются значениями момента импульса. Электрон находящийся в состоянии с l=0 называют s-электрон, с l=1 – p – электрон, 2 – d – электрон, 3 – f – электрон. Значение квантового числа ставится перед обозначением азимутального, т.е. электрон с n=3 и l=1 это 3s электрон.