Принцип Паули. Периодическая система химических элементов Д.И.Менделеева.
Принцип Паули: в одном и том же атоме (или в какой-либо другой квантовой системе) не может быть двух электронов (либо других частиц с полуцелым спином), обладающих одинаковой совокупностью квантовых чисел. Иными словами, в одном и том же состоянии не могут находиться одновременно два электрона.
Каждый электрон в атоме движется в первом приближении в центрально-симметричном некулоновском поле. Состояние электрона в этом случае определяется тремя квантовыми числами n, l и m.
Таким образом, состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: главным n (n=1,2,3,…), азимутальным 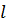 (
(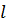 =0,1,2,…,n-1), магнитным
=0,1,2,…,n-1), магнитным 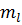 (
(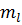 = -
= -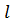 ,…,-1,0,+1,…,+
,…,-1,0,+1,…,+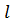 ), спиновым
), спиновым 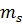 (
(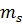 = +1/2,-1/2). Энергия состояния зависит в основном от чисел n и
= +1/2,-1/2). Энергия состояния зависит в основном от чисел n и 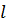 .
.
Данному n соответствует n2 состояний, различающихся значениями 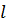 и
и 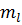 . Квантовое число
. Квантовое число 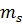 может принимать два значения:
может принимать два значения: 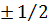 . Поэтому в состояниях с данным значением n могут находиться в атоме не более 2n2 электронов:
. Поэтому в состояниях с данным значением n могут находиться в атоме не более 2n2 электронов:
n = 1 могут иметь 2 электрона, n = 2 могут иметь 8 электронов, n = 3 могут иметь 18 электронов, n = 4 могут иметь 32 электрона, n = 5 могут иметь 50 электронов и т.п.
Совокупность электронов, имеющих одинаковые значения квантового числа n, образует оболочку. Оболочки подразделяются на подоболочки, различающиеся значением квантового числа 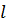 . В соответствии с значением n оболочкам дают обозначения, заимствованные из спектроскопии рентгеновских лучей:
. В соответствии с значением n оболочкам дают обозначения, заимствованные из спектроскопии рентгеновских лучей:
Значение n 1 2 3 4 5 6 7 …
Обозначение оболочки K L M N O P Q …