Основное уравнение молекулярно-кинетической теории газов
Рассмотрим в качестве простейшей физической модели идеальный газ. Идеальным называется такой газ, для которого выполняются следующие условия:
1) размеры молекул настолько малы, что их можно рассматривать как материальные точки;
2) потенциальная энергия взаимодействия между молекулами равна нулю при любом расстоянии между ними — лишь в момент столкновения между молекулами возникают упругие силы отталкивания.
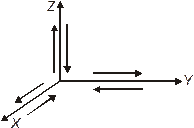
Хаотическое движение молекул газа можно представить как движение 1/3 общего их числа в направлении оси x, 1/3 — вдоль оси y, 1/3 — вдоль оси z. При этом в положительном направлении оси движется 1/2 соответствующего числа молекул, т.е. 1/6 часть — рис. 15.1.
| 
|
| Рис. 15.1 | Рис. 15.2 |
Подсчитаем теперь число молекул, которые пересекают площадку сечением S, ориентированную перпендикулярно к оси х, за время dt — рис. 15.2. Для упрощения выкладок будем считать, что скорости всех молекул одинаковы и равны некоторому значению v. Число молекул dN, пересекающих площадку в положительном направлении осих, очевидно, пропорционально площади S, числу молекул п в единице объёма,их скорости v, а также времени dt:
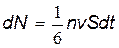 . .
| (15.1) |
Заменим теперь воображаемую площадку S стенкой сосуда. При ударе молекулы о стенку направление её скорости изменяется на противоположное, поэтому изменение импульса молекулы
 . .
| (15.2) |
Импульс, сообщённый стенке за счёт dNударов, найдём перемножением выражений (15.1) и (15.2):
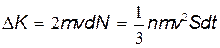 . .
| (15.3) |
Сила давления, возникающая за счёт ударов молекул о стенку сосуда, находится по второму закону Ньютона 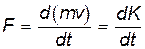 , а давление
, а давление
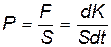 .
.
В результате получим:
 . .
| (I5.4) |
Если учесть, что молекулы движутся с различными скоростями, то в формуле (15.1) v нужно заменить на среднюю скорость vср:
 ,
,
а в формуле (15.4) v2 на среднюю квадратичную скорость
 .
.
В результате получим:
 ; ;
| (15.5) |
 . .
| (15.6) |
Введём в рассмотрение среднюю кинетическую энергию хаотического движения молекул
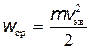 . .
| (15.7) |
С учётом (15.7) выражение (15.6) можно переписать в виде:
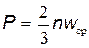 . .
| (15.8) |
Формула (15.8) есть основная формула молекулярно-кинетической теории газов для давления. Видно, что давление газа пропорционально средней энергии хаотического движения молекул.
Заменив в формуле (15.8) число молекул в единице объёма nна общее число молекул в объёме N=nV, получим:
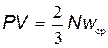 . .
| (15.9) |
Правая часть этого выражения остаётся величиной постоянной, если температура газа Т =const, поэтомуPV=const.
Таким образом, получен закон Бойля-Мариотта, который, как известно, является частным случаем уравнения Менделеева-Клапейрона при Т = const. Для одного моля газа это уравнение имеет вид:
| PV0=RT, | (15.10) |
гдеV0 — объём одного моля газа; R — универсальная газовая постоянная.
Если теперь записать уравнение (15.9) для одногомоля:
 ,
,
где NA — число Авогадро, и сравнить его с уравнением Менделеева-Клапейрона (15.10), то
 .
.
Из последнего уравнения следует
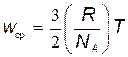 .
.
Отношение двух универсальных констант R и NA есть также универсальная постоянная. Эта постоянная обозначается буквой k и называется постоянной Больцмана: k=R/NA.
Таким образом, средняя кинетическая энергия хаотического движения молекул пропорциональна температуре
 . .
| (15.11) |
Формула (15.11) есть основная формула молекулярно-кинетической теории газов для энергии молекулы. С помощью этой формулы можно дать молекулярно-кинетичеcкое толкование температуры. Поскольку T ~ wср, то можно сказать, что температура есть величина, пропорциональная средней кинетической энергии хаотического теплового движения молекул. Заметим, что понятие температуры справедливо для равновесных систем, состоящих из очень большого числа частиц.
В заключение параграфа найдём связь между давлением газа и температурой. Подставляя (15.11) в (15.8), получаем:
| P=nkT. | (15.12) |