Первое начало термодинамики и его применение к изопроцессам
Первое начало термодинамики — это обобщение закона сохранения энергии с учётом тепловых процессов. Его формулировка: количество теплоты, сообщённое системе, расходуется на выполнение работы против внешних сил и изменение её внутренней энергии:
| dQ=dA+dU. | (20.1) |
Первому началу термодинамики можно дать другую формулировку, если учесть, что dA=dQ-dU, т.е.
dA dQ. dQ.
| (20.2) |
На основании (20.2) первое начало термодинамики можно сформулировать следующим образом: невозможно построить тепловой двигатель, который совершал бы работу большую, чем количество затраченной теплоты.
Применим первое начало термодинамики к различным изопроцессам.
1. Изохорный процесс (V=const). В этом процессе объём системы остаётся постоянным, поэтомуdA=PdV=0 и dQ=dU.В изохорном процессе теплота, подведенная к системе, полностью расходуется на изменение её внутренней энергии.
2. Изобарный процесс (Р=сonst). Так как объём изменяется, то при подведении теплоты к системе она частично превращается в работу и поэтому первое начало термодинамики имеет вид:dQ=dA+dU.
Вычислим согласно (19.2) работу, совершаемую системой при изобарном процессе
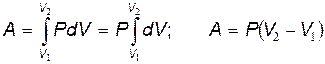 . .
| (20.3) |
3. Изотермический процесс (T=const). При постоянной температуре изменения внутренней энергии идеального газа не происходит: dU=0, поэтомуdQ=dA.
В изотермическом процессе вся теплота, подведенная к газу, расходуется на совершение работы.
Поскольку давление P¹const, то в (19.2) его нельзя выносить за знак интеграла. Выразим давление Р через объём V с помощью уравнения Менделеева-Клапейрона:
 . .
| (20.4) |
Подставляя (20.4) в (19.2), получим:
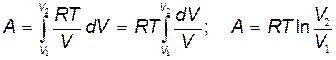 . .
| (20.5) |