Число степеней свободы. Внутренняя энергия идеального газа
Числом степеней свободы называется число независимых координат, которыми описывается движение тела в пространстве. Материальная точка имеет три степени свободы, поскольку при её движении в пространстве изменяются три координаты x, y и z.
 Рис. 21.1
Рис. 21.1
|
Система из двух материальных точек, расстояние между которыми остаётся постоянным, имеет пять степеней свободы: три из них приходятся на поступательное движение и две — на вращательное вокруг осей x и z (рис. 21.1). Вращение вокруг оси y не даёт дополнительной степени свободы, так при этом положение материальных точек в пространстве не изменяется.
Средняя кинетическая энергия поступательного движения молекулы равна 3/2 kТ — формула (15.11). Это движение можно рассматривать как движение с тремя степенями свободы, поскольку молекулы идеального газа можно принять за материальные точки. Все три степени свободы равноправны, поэтому можно считать, что на одну степень свободы приходится энергия
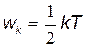 . .
| (21.1) |
В статистической физике доказывается, что на любую степень свободы движения молекулы (поступательную, вращательную и т.д.) приходится одна и та же энергия, равная 1/2 kТ. Это утверждение носит название закона равнораспределения энергии по степеням свободы.
В общем случае, когда молекула имеет i степеней свободы, её кинетическая энергия
 . .
| (21.2) |
Подсчитаем теперь внутреннюю энергию одного киломоля идеального газа. Эта энергия может быть найдена умножением средней энергии одной молекулы на их число, т.е. число Авогадро:
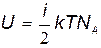 .
.
Поскольку kNA=R, где R — универсальная газовая постоянная, то
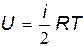 . .
| (21.3) |
Из (21.З) видно, что внутренняя энергия идеального газа полностью определяется его температурой.
22. Классическая теория теплоёмкости газов
Различают молярную теплоёмкость С (количество теплоты, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на 1 К) и удельную теплоёмкость (рассчитывается на единицу массы). Между молярной С и удельной С0 теплоёмкостью существует связь C=mC0, где m — молярная масса.
Для газа существенно, каким образом происходит его нагревание, поэтому различают:
1) теплоёмкость при изотермическом процессе 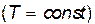
 ;
;
2) теплоёмкость при изохорном процессе  ;
;
3) теплоёмкость при изобарном процессе 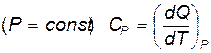 .
.
При изотермическом процессе температура не меняется, поэтому 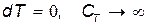 .
.
При изохорном процессе dQ=dU, так как работа в таком процессе не совершается, поэтому
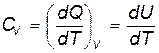
| (22.1) |
и, следовательно,
| dU=CVdT. | (22.2) |
Теплоёмкость при постоянном давлении
 . .
| (22.3) |
Представим с помощью уравнения Менделеева-Клапейрона элементарную работу, совершаемую одним молем идеального газа при изобарном процессе в виде
| dA=PdV=RdT. | (22.4) |
Подставив (22.4) в (22.3), получим формулу Майера
| CP = CV+R, | (22.5) |
т.е. CP >CV на величину универсальной газовой постоянной.
Выразим теперь молярные теплоёмкостиCVи CP через число степеней свободы. С учётом(2I.3), из (22.3) следует
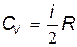 . .
| (22.6) |
ЗнаяCV, из формулы Майера находим
 . .
| (22.7) |
Отношение
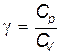
| (22.8) |
называется коэффициентом Пуассона. Этот коэффициент с помощью (22.6) и (22.7) можно выразить через число степеней свободы
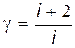 . .
| (22.9) |
Для одноатомного газа(i=3)g = 1,67; для двухатомного (i=5) g= 1.40; для многоатомного(i=6)g= 1,33.