Адиабатный процесс
Адиабатным называется процесс, происходящий без теплообмена с окружающей средой.
В адиабатном процессеdQ = 0, поэтому первое начало термодинамики применительно к этому процессу принимает вид
| dA + dU = 0; dA = -dU, | (23.1) |
т.е. при адиабатном процессе газ совершает работу за счёт внутренней энергии.
С помощью (19.1) и (22.2) выражение (23.1) можно представить в виде
| PdV = -CVdT. | (23.2) |
Видно, что при адиабатном расширении(dV>0) dT<0, т.е. газ охлаждается. И, наоборот, при адиабатном сжатии (dV<0) dT>0, т.е. газ нагревается.
Выразим в (23.2) давление Р с помощью уравнения Менделеева – Клапейрона через другие параметры состояния и разделим в полученном уравнении переменные:
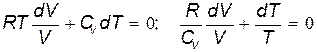 .
.
Поскольку R = CP - CV , то  ,
,
поэтому

Проинтегрируем полученное уравнение:
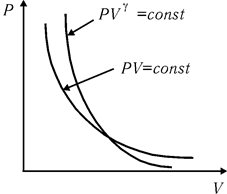 Рис. 23.1
Рис. 23.1
|
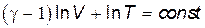 .
.
Отсюда после потенцирования
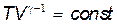 . .
| (23.3) |
Это и есть уравнение адиабаты в координатах Т и V. Его можно записать в координатахPиV,если в(23.3) подставить температуру из уравнения Менделеева – Клапейрона:
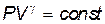 . .
| (23.4) |
Поскольку g>1, то график адиабаты выглядит круче изотермы — рис. 23.1.