Энтропия
Введём теперь новый параметр состояния термодинамической системы — энтропию, которая принципиально отличается от других параметров состояния направленностью своего изменения. Элементарное изменение энтропии определяется как отношение бесконечно малого количества теплоты, сообщённого термодинамической системе в обратимом процессе, к её температуре:
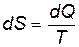 . .
| (27.1) |
Используя формулу (21.7), запишем выражение первого начала термодинамики (20.1) в виде
TdS=dA+dU
и проинтегрируем его при условии Т=const:
T(S2–S1)=A12+(U2–U1) или A12=(U1–TS1)–(U2–TS2)
Обозначим
| F = U–TS, | (27.2) |
тогда
| A12=F1–F2; | (27.3) |
| U=F+TS. | (27.4) |
Величина F носит название свободной энергии термодинамической системы, a TS — связанной энергии. Из (27.4) видно, что внутреннюю энергию можно представить как сумму свободной и связанной энергий. Свободная энергия — это та часть внутренней энергии, которая может быть целиком превращена в работу при постоянной температуре. Связанная энергия представляет ту часть внутренней энергии, которая не может быть целиком превращена в работу. При данной температуре связанная энергия пропорциональна энтропии, поэтому можно сказать, что энтропия есть мера связанной энергии термодинамической системы.
Рассмотрим теперь понятия свободной и связанной энергий, а также энтропии с точки зрения молекулярно-кинетической теории на примере простейшей термодинамической системы — идеального газа.
Внутренняя энергия идеального газа, как уже было, отмечено, представляет собой суммарную кинетическую энергию хаотического движения молекул. Если система выполняет работу, то часть энергии хаотического движения преобразуется в энергию направленного движения. Поэтому можно сказать, что свободная энергия — это та часть энергии хаотического движения, которая может быть преобразована в энергию направленного движения при постоянной температуре.
Связанная энергия — это та часть энергии хаотического движения, которая не может быть преобразована в энергию направленного движения. При этом, чем больше энтропия, тем большую часть энергии хаотического движения нельзя превратить в энергию направленного движения. Поэтому можно сказать, что энтропия есть мера хаотичности системы.
Рассмотрим теперь изменение энтропии на примере обратимого и необратимого процессов.
1.Адиабатный процесс. Такой процесс является обратимым. Поскольку для адиабатического процессаdQ=0, то
| dS=0. | (27.5) |
 Рис. 27.1
Рис. 27.1
|
2. Процесс теплопередачи. Как уже отмечалось, такой процесс является необратимым. Поскольку Т1>Т2, то теплопередача происходит в направлении от первого тела ко второму — рис. 27.1.
Элементарное изменение энтропии каждого из тел

где с1 и с2 — удельные теплоёмкости тел, а знак "–" в выражении для dS1 подтверждает, что теплота отдаётся горячим телом холодному. Изменение энтропии всей системы

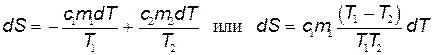 .
.
При этом использовано то, что количество теплотыc1m1dT,отданное первым телом, равно количеству теплоты c2m2dT, полученному вторым телом. Поскольку Т1>Т2, то из последнего соотношения видно, что процесс теплопередачи сопровождается ростом энтропии:
| dS>0. | (27.6) |
Соотношение (27.6) справедливо не только для процесса теплопередачи. Можно показать, что оно выполняется для любого необратимого процесса. Таким образом, в замкнутых системах необратимые процессы протекают в таком направлении, которое ведёт к возрастанию энтропии системы.
Объединяя результаты, полученные для обратимых и необратимых процессов, можно сформулировать второе начало термодинамики в виде
| dS³0, | (27.7) |
т.е. в замкнутых системах могут протекать лишь такие процессы, при которых энтропия системы не убывает. При переходе термодинамической системы из неравновесного состояния в равновесное энтропия увеличивается. В равновесном состоянии энтропия достигает наибольшего значения и в дальнейшем при отсутствии внешних воздействий сохраняется постоянной.