Скорости молекул. Распределение молекул по скоростям
Для характеристики скорости теплового движения выразим среднюю квадратичную скорость молекулы через температуру газа Т.
Средняя кинетическая энергия ‹ε0› поступательного движения молекулы массой m0, с одной стороны равна
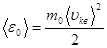 (8.19)
(8.19)
С другой стороны, эта энергия может быть определена через температуру
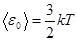 (8.20)
(8.20)
Сопоставляя (8.19) и (8.20), получим среднюю квадратичную скорость молекулы идеального газа
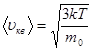 (8.21)
(8.21)
Полученную скорость часто называют просто тепловой скоростью, так как в формулу (8.21) вместо m0 c успехом можно подставить массу атома, молекулы или броуновской частицы. Применяя формулу (8.21) к молекулам, ей удобно придать другой вид. Учитывая, что  , получим
, получим
 (8.22)
(8.22)
где, R – молярная газовая постоянная; m = m0 Na – масса газа (Na – число Авогадро).
Скорости движения молекул в газе различны. Но, согласно, молекулярно-кинетической теории, какие бы ни были скорости, для газа определенной температуры средняя квадратичная скорость молекул массой m0 находящихся в состоянии равновесия остается величиной постоянной и определяется по формуле (8.21) или (8.22).
Это объясняется тем, что в газе, находящимся в состоянии равновесия, устанавливается некоторые стационарные не изменяющиеся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону. Этот закон теоретически вывел Максвелл[6].
Задача о статистическом распределении молекул по скоростям сводиться к установлению числа молекул, которые обладают скоростями, лежащими в интервале u, u + du. Это количество молекул dN прямо пропорционально общему количеству молекул N, ширине интервала du и зависит от величины скорости
 (8.23)
(8.23)
где ƒ(u) – функция распределения молекул газа по скоростям; 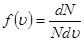 – показывает относительное число молекул, приходящихся на единицу интервала скоростей.
– показывает относительное число молекул, приходящихся на единицу интервала скоростей.
Функция ƒ(u) для равновесных состояний газа вычислена теоретически и проверена путем измерений. По Максвеллу она имеет вид
 (8.24)
(8.24)
где А и В – постоянные, зависящие от массы и температуры
 ,
, 
Графики ƒ(u) для разных температур представлены на рис.8.2.
Площадь заштрихованной части при малых значениях du будет 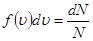 , т.е. равна доле общего числа молекул, обладающих скоростью, лежащей в интервале от u до u + du.
, т.е. равна доле общего числа молекул, обладающих скоростью, лежащей в интервале от u до u + du.
Скорость uв, соответствующая максимуму кривой, называетсянаиболее вероятной скоростью.Значениеuв можно найти, продифференцировав выражение по аргументу и приравняв результат нулю, используя условия для максимума функции ƒ(du)
 (8.25)
(8.25)
