Первое начало термодинамики
В термодинамике закон сохранения энергии выражается в виде I начала термодинамики, который формулируется следующим образом: теплота dQ, подведенная к замкнутой системе, расходуется на увеличение внутренней энергии dU и работу dA, производимую системой против внешних сил, т.е.
dQ = dU + dA (10.1)
Полученное уравнение носит название уравнения Клаузиуса[8]. В более корректной форме уравнение (10.1) имеет вид
dQ = dU + dA, (10.2)
где dQ, dA – бесконечно малые величины. Однако, в таком изменение записи нет необходимости и в дальнейшем будем пользоваться формулой (10.1).
Внутренняя энергия системы складывается из кинетических и потенциальных энергий частиц, составляющих данную систему
U = Ек + Еп (10.3)
Для идеального газа Еп = 0 и внутренняя энергия определяется только кинетической энергией молекул газа, т.е. U = Ек.
Для одного моля газа Екm
 , (10.4)
, (10.4)
где <e0> – средняя кинетическая энергия одной молекулы, Na – число Авогадро, i – число степеней свободы молекул, Т – температура, R – молярная газовая постоянная.
Для произвольной массы газа m
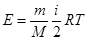 , (10.5)
, (10.5)
где М – молярная масса газа.
Изменение внутренней энергии
 (10.6)
(10.6)
Внутренняя энергия газа может изменяться в результате или процесса теплопередачи, или процесса совершения работы.
Рассмотрим, что собой представляет в термодинамике работа dA. При нагревании газа (передача теплоты dQ) поршень поднимается – газ совершает работу против внешних сил (рис.9.1)
dA = Fdh, (10.7)
где F = PS, P – давление газа, S – площадь поршня.
Тогда
dA = PSdh = PdV, (10.8)
где dV – изменение объема газа.
После соответствующих подстановок уравнение Клаузиуса примет вид
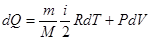 (10.9)
(10.9)
Графически работа изображается площадью под кривой, а заштрихованная площадь (рис. 10.2) вычисляется по формуле (10.8).
 Рис.10.1
Рис.10.1
| 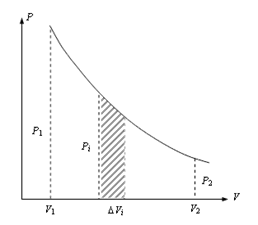 Рис.10.2
Рис.10.2
|
Полную работу А, совершаемая газом при изменении его объема от V1 до V2 найдем интегрируя уравнение (10.8)
 (10.10)
(10.10)