Теплоемкости газов
Удельной теплоемкостью вещества С называется количество теплоты dQ, необходимое для нагревания газа массой m = 1 кг на 1 градус
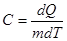 ,
,  (10.11)
(10.11)
Молярной теплоемкостью Сm называют количество теплоты, необходимое для нагревания 1 моля вещества на 1 К
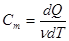 ,
, 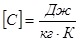 (10.12)
(10.12)
где 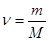 – количество молей (количество вещества), М – молярная масса.
– количество молей (количество вещества), М – молярная масса.
Удельная и молярная теплоемкости связаны соотношением
Сm = СМ (10.13)
Из I-го начала термодинамики следует, что теплоемкость газа зависит от способа передачи энергии. Передача теплоты газу может осуществляться при V = const или при P = const.
Для одного моля газа I начало термодинамики имеет вид
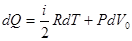 , (10.14)
, (10.14)
где V0 – объем одного моля газа.
При V = const dA = 0 и dQ = dU. Тогда молярная СmV и удельная СV теплоемкости равны соответственно
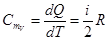 ,
, 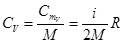 (10.15)
(10.15)
Теперь рассмотрим теплоемкость при P = const.
Для одного моля газа
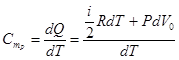 , (10.16)
, (10.16)
Воспользуемся уравнением Менделеева-Клапейрона и подставим в (10.16) 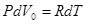 . Тогда молярная CmP и удельная CP теплоемкости равны соответственно
. Тогда молярная CmP и удельная CP теплоемкости равны соответственно
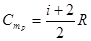 ,
, 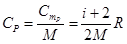 (10.17)
(10.17)
Сравнивая уравнения (10.15) и (10.17), видим, что теплоемкость при P = const больше теплоемкости при V = const. Это объясняется тем, что тепло, сообщаемое газу при P = const идет не только на увеличение внутренней энергии, но и дополнительно на совершение работы против внешних сил (на увеличение объема). Согласно сказанному, для одного моля газа
Сmp – CmV = R (10.18)
Выражение (10.18) называется уравнением Майера[9], которое раскрывает физический смысл молярной газовой постоянной R – она равна работе, совершаемой молем идеального газа при повышении температуры на 1К при P = const.
При изучении термодинамических процессов важно знать отношение 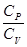 (вне зависимости от того, молярные это теплоемкости или удельные), которое зависит от свойств газа
(вне зависимости от того, молярные это теплоемкости или удельные), которое зависит от свойств газа
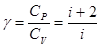 (10.19)
(10.19)
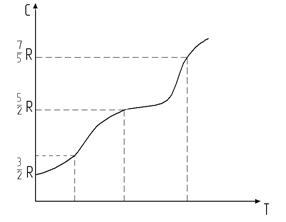
Из формул (10.15) и (10.17) следует, что теплоемкости не зависят от температуры, а определяются лишь числом степеней свободы составляющих вещество молекул. Это утверждение справедливо только для одноатомных газов. Для двухатомных наблюдается расхождение между теорией и экспериментальными данными. На рис.9.3 представлена экспериментальная кривая зависимости СV от Т для молекул водорода. Разным температурам соответствует свое значение теплоемкости.